
 水合肼作为一种重要的精细化工原料,在农药、医药及有机合成中有广泛用途.用尿素法制水合肼,可分为两个阶段,第一阶段为低温氯化阶段,第二阶段为高温水解阶段,总反应方程式为:CO (NH2)2+NaClO+2NaOH→H2N-NH2•H2O+NaCl+Na2CO3.
水合肼作为一种重要的精细化工原料,在农药、医药及有机合成中有广泛用途.用尿素法制水合肼,可分为两个阶段,第一阶段为低温氯化阶段,第二阶段为高温水解阶段,总反应方程式为:CO (NH2)2+NaClO+2NaOH→H2N-NH2•H2O+NaCl+Na2CO3.分析 (1)由(NH2)2CO+NaClO+2NaOH→N2H4•H2O+NaCl+Na2CO3可知,检测NaClO浓度可确定尿素和NaOH的用量、NaClO溶液的体积;
(2)该反应极易发生副反应,所以这样做的目的是减少副反应的发生,提高水合肼的产率;
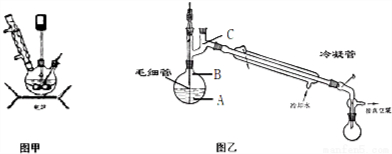
(3)进行蒸馏分离出产品,需要防止蒸馏烧瓶内液体暴沸,温度计测定馏分的沸点;
(4)①碘水具有强氧化性,能腐蚀碱式滴定管的橡胶;
②反应中消耗单质碘的物质的量是1.8×10-3mol,由N2H4+2I2=N2+4HI可知水合肼的物质的量,进而计算其质量分数;
③要减少实验误差,则步骤d中进一步操作主要是重复步骤b和c2~3次,依据测得的结果,取平均值.
解答 解:(1)由(NH2)2CO+NaClO+2NaOH→N2H4•H2O+NaCl+Na2CO3可知,检测NaClO浓度可确定尿素和NaOH的用量、NaClO溶液的体积,因此也需要步骤1中需要检测NaClO浓度,故选:AC;
(2)该反应极易发生副反应,所以这样做的目的是减少副反应的发生,提高水合肼的产率,
故答案为:减少副反应的发生,提高水合肼的产率;
(3)进行蒸馏分离出产品,在蒸馏过程中毛细管可起防止暴沸的作用,蒸馏时温度计在蒸馏烧瓶的支管处,即图中C位置,
故答案为:防止暴沸;C;
(4)①碘水能腐蚀碱式滴定管的橡胶,则碘水应装在酸式滴定管中,故答案为:酸式滴定管;
②反应中消耗单质碘的物质的量是1.8×10-3mol,由N2H4+2I2=N2+4HI,可知水合肼的物质的量是0.9×10-3mol,所以产品中N2H4.H2O的质量分数为$\frac{9×1{0}^{-4}mol×50g/mol×\frac{250mL}{10mL}}{2.000g}$×100%=56.25%,故答案为:56.25%;
③减少实验误差,则步骤d中进一步操作主要是重复步骤b和c2~3次,依据测得的结果,取平均值,故答案为:重复步骤b和c2~3次,依据测得的结果,取平均值.
点评 本题考查有机物的制备方案,涉及对操作的分析评价、滴定计算等,侧重对学生基础知识的巩固与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 11.2 LNH3中所含的质子数为5NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA个 | |
| C. | 2.4g金属镁变为Mg2+时失去的电子数为0.1 NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为 NA 个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量醋酸加入NaAlO2溶液中:CH3COOH+AlO${\;}_{2}^{-}$+H2═CH3COO-+Al(OH)3↓ | |
| B. | 将钠粒投入CuSO4溶液中:2Na+Cu2+═Cu+2Na+ | |
| C. | 将NaHSO4溶液滴加到含有酚酞的Ba(OH)2溶液中,溶液由红色变成无色:Ba2++OH-+H++SO${\;}_{4}^{2-}$═BaSO4↓+H2O | |
| D. | 硫化钠溶液中加入少量的氯化铁溶液:S2-+Fe3+═Fe2++S↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸与氢氧化钡溶液混合产生沉淀:Ba2++SO${\;}_{4}^{2-}$=BaSO4↓ | |
| B. | 用大理石与稀盐酸制备二氧化碳:CO${\;}_{3}^{2-}$+2H+=CO2↑+H2O | |
| C. | 用氢氧化钠溶液吸收氯气:Cl2+2OH-=ClO-+Cl-+H2O | |
| D. | 铜片放入稀硝酸中产生气体:Cu+4H++2NO${\;}_{3}^{-}$=Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Z两种元素可形成X2Z和X2Z2两种常见共价化合物 | |
| B. | M与Z形成的化合物的分子式为M2Z3 | |
| C. | 工业上可用电解熔融的W的氯化物的方法制取W的单质 | |
| D. | Z元素对应的单质与W元素对应的单质在不同条件下反应产物可能不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(逆)>V(正) | B. | V(逆)<V(正) | ||
| C. | V(逆)>V(正),正逆反应停止 | D. | V(逆)=V(正),正逆反应仍进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L CCl4所含分子数为0.5NA | |
| B. | 56g Fe与足量的盐酸反应转移电子数为3NA | |
| C. | 1mol铁元素转化成氢氧化铁胶体后,便有NA个氢氧化铁胶体微粒 | |
| D. | 常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 含1mol HPE的溶液最多可以和2molNaOH反应 | |
| B. | HPE不能跟浓溴水反应 | |
| C. | 1molHPE能与4molH2发生加成反应 | |
| D. | HPE分子中最多有12个原子共平面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com