
����Ŀ��������ԭ��Ӧ�������������о��й㷺����;���ᴩ�Ž�
��1��ˮ���������Ҫ��ɲ��֣��������к�������һ�����ʣ��������ֻ�����Ӧ������������ԭ��Ӧ�Ĺ�ϵ��Ҳ����ͼ1�����д����ˮ�μӵķ��Ϸ�Ӧ���͢���һ����ѧ����ʽ�� �� ����ˮΪ����
��2��������������˫��ˮ��ҽ������������ɱ��������������ϴ�˿ڣ�����˫��ˮ���ش��������⣺ �����з�Ӧ�У�H2O2�����������������ֻ�ԭ�Եķ�Ӧ��
A��Na2O2+2HCl�T2NaCl+H2O2 B��Ag2O+H2O2�T2Ag+O2��+H2O
C��2H2O2�T2H2O+O2�� D��3H2O2+Cr2��SO4��3+10KOH�T2K2CrO4+3K2SO4+8H2O
�ڱ������������Լ�ƿ�����ʺ����ϵ�һ����ǩ��ͼ2��������ţ�
��3������ͭ��ʱ��������NH4Cl ��ȥ����������ͭ�ٽ��к��ӣ��÷�Ӧ�ɱ�ʾΪ��4CuO+2NH4Cl ![]() 3Cu+CuCl2+N2��+4H2O ����˫���ű�������ת�Ƶķ������Ŀ ��
3Cu+CuCl2+N2��+4H2O ����˫���ű�������ת�Ƶķ������Ŀ ��
�ڸ÷�Ӧ�У���������Ԫ���� �� �������� ��
�ۻ�ԭ����������������ʵ���֮��Ϊ ��
�ܷ�Ӧ��������0.2mol�ĵ���������mol�ĵ���ת�ƣ�
���𰸡�
��1��2Na+2H2O=2NaOH+H2��������
��2��C��B
��3��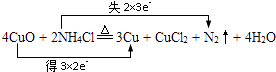 ��N��CuO��2:1��1.2
��N��CuO��2:1��1.2
���������⣺��1����ͼ��֪����Ϊ������ԭ��Ӧ���������û���Ӧ����2Na+2H2O=2NaOH+H2����ˮ��HԪ�صĻ��ϼ۽��ͣ���ˮΪ�����������Դ��ǣ�2Na+2H2O=2NaOH+H2������������2����A��Na2O2+2HCl�T2NaCl+H2O2�У���������Ϊ�����B��Ag2O+H2O2�T2Ag+O2��+H2O��OԪ�صĻ��ϼ����ߣ�ֻ���ֹ�������Ļ�ԭ�ԣ� C��2H2O2�T2H2O+O2����HԪ�صĻ��ϼ۽��ͣ�OԪ�صĻ��ϼ����ߣ������������Ժͻ�ԭ�ԣ�D��3H2O2+Cr2��SO4��3+10KOH�T2K2CrO4+3K2SO4+8H2O��OԪ�صĻ��ϼ۽��ͣ�ֻ���ֹ�������������ԣ����Դ��ǣ�C����˫��ˮ�����������������������ԣ������ñ�ǩB�����Դ��ǣ�B����3����Cu��+2�۽���Ϊ0��NԪ�صĻ��ϼ��ɩ�3������Ϊ0���÷�Ӧת��6e�� �� ��˫���ű�������ת�Ƶķ������ĿΪ  �����Դ��ǣ�
�����Դ��ǣ�  ����NԪ�صĻ��ϼ�����ʧȥ���ӱ�������CuԪ�صĻ��ϼ۽��ͣ���CuOΪ�����������Դ��ǣ�N��CuO���ۻ�ԭ��ΪNH4Cl����������ΪN2 �� �ɷ�Ӧ��֪����ԭ����������������ʵ���֮��Ϊ2��1�����Դ��ǣ�2��1�����ɷ�Ӧ��֪������1mol����ת��6mol���ӣ������0.2mol������ת�Ƶĵ���Ϊ0.2mol��6mol=1.2mol�����Դ��ǣ�1.2��
����NԪ�صĻ��ϼ�����ʧȥ���ӱ�������CuԪ�صĻ��ϼ۽��ͣ���CuOΪ�����������Դ��ǣ�N��CuO���ۻ�ԭ��ΪNH4Cl����������ΪN2 �� �ɷ�Ӧ��֪����ԭ����������������ʵ���֮��Ϊ2��1�����Դ��ǣ�2��1�����ɷ�Ӧ��֪������1mol����ת��6mol���ӣ������0.2mol������ת�Ƶĵ���Ϊ0.2mol��6mol=1.2mol�����Դ��ǣ�1.2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ڹ�ũҵ����������Ҫ���á�
��1������N2H4�����ֳ����ĵ��⻯�����֪��
4NH3��g��+3O2��g��![]() 2N2��g��+6H2O��g����H1=-541.8kJ��mol-1
2N2��g��+6H2O��g����H1=-541.8kJ��mol-1
N2H4��g��+O2��g��![]() N2��g��+2H2O��g����H2=-534kJ��mol-1
N2��g��+2H2O��g����H2=-534kJ��mol-1
��NH3��g����O2��g����ȡN2H4��g�����Ȼ�ѧ����ʽΪ_______________
��2������������һ���������ܷ������·�Ӧ��
NO2��g��+SO2��g��![]() SO3��g��+NO��g�� ��H=-42kJ��mol-1
SO3��g��+NO��g�� ��H=-42kJ��mol-1
�����Ϊ2L�ĺ����ܱ������г���SO2��g����NO2��g����ʵ�������������£�
ʵ���� | �¶� | ��ʼ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | |
n��SO2�� | n��NO2�� | n��NO�� | ||
�� | T1 | 4 | 2 | 0.8 |
�� | T2 | 2 | 4 | 0.6 |
�� | T1 | 2 | 1 | a |
����ʵ����У���2minʱ��÷ų���������8.4kJ�����¶��µ�ƽ�ⳣ��Ϊ_______��������С�������λ��
���ɱ������ݿ���֪T1_____T2������������������=����
��ʵ����У��ﵽƽ��ʱNO2��ת����Ϊ_______
��3��ʹ�ü�ӵ绯ѧ�����Դ���ú�����е�NO����Ӧԭ������ͼ��ʾ����֪������Һ��pH��4-7֮�䣬д�������ĵ缫��Ӧʽ____________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������9.11���ֲ��¼���ŦԼ����һ�����صĻ������ѡ�ʯ����Ⱦ����ʹ����ʯ����ά���β�����֪ʯ���ǹ����ο��ij��ʯ�Ļ�ѧʽ�ɱ�ʾΪ��Ca2MgxSiyO22��OH��2��ʽ��x��y��ֵ�ֱ�Ϊ�� ��
A. 8��3 B. 5��8 C. 3��8 D. 8��5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԴΣ���ǵ�ǰһ��ȫ�������⡣��ش��������⣺
��1������������������Դ����Դ����������_____________������ĸ����
a.������չũ���������������Ľո�ת��Ϊ����Ч����Դ
b.��������ú��ʯ�ͺ���Ȼ������������������������Դ����
c.������Դ���ģ�ע����Դ���ظ�ʹ�á���Դ��ѭ������
��2��������һ������������ȼ�ϡ���֪1g ������ȫȼ������CO2��H2O(l)�����У��ų�55.6kJ ������д����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ��____________________________��
��3����֪ϡ��Һ�У���30g���ʵĴ�����Һ��NaOH ��Һǡ����ȫ��Ӧʱ���ų�28.55kJ������д����ʾ������NaOH ��Ӧ���к��ȵ��Ȼ�ѧ����ʽ��___________________��
��4����֪�� CH4(g)+2O2(g) =CO2(g)+2H2O(l) ��H=-890.3kJmol-1
N2(g)+O2(g) ==2NO(g) ��H=+180kJmol-1
CH4 ���������������Ȼ�ѧ����ʽΪCH4(g)+4NO(g)==CO2(g)+2N2(g)+2 H2O(l) ��H=__________��
��5������ͼ��298 KʱN2��H2��Ӧ�����������仯������ͼ���÷�Ӧ���Ȼ�ѧ����ʽΪ��_____________________________��

��6����֪�������л�ѧ����Ҫ���յ������ֱ�Ϊ�� H-H a kJmol-1\��H-O b kJmol-1��O=O c kJmol-1�������й����ݹ��������������ķ�Ӧ��2H2+O2=2H2O �÷�Ӧ����H=_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Թ��ȸʯ����Ҫ�ɷ�Ϊ CuCO3��Cu(OH)2��CuSiO3��2H2O���� SiO2��FeCO3�� Fe2O3��������Ϊԭ���Ʊ�CuCl2�Ĺ����������£�

��֪��SOCl2+H2O![]() SO2��+2HCl��
SO2��+2HCl��
��1���������ʱ������CuCO3Cu(OH)2��Ӧ�Ļ�ѧ����ʽΪ____��Ϊ����������ʱͭԪ�صĽ����ʣ����Բ�ȡ�Ĵ�ʩ�У����ʵ��ӿ�������ʣ���______________�����δ�һ�㼴�ɣ�
��2����������ʱ������Ӧ�����ӷ���ʽΪ__________��
��3��������1������Ҫ�ɷ�ΪSiO2��H2SiO3�ȣ�������2������Ҫ�ɷ�Ϊ______________���ѧʽ�����Լ�X��ѡ��_____������ĸ����
a. Cu b. NaOH c. Cu(OH)2 d.��ˮ
��4������pH��ʱ��pH���ܹ��ߣ���ԭ����_________________________��
��5����������ˮ��ʱ������SOCl2��Ŀ����_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�к�����Ϊ���뷴Ӧ������ʵ�����������Ϊ������������������ʵ��������з�Ӧ��Ӧ�����ߴ�����ǣ� ��

A. ��NaAlO2��Һ�е���HCl������
B. �����ʯ��ˮ��ͨ��CO2������
C. ��Na2CO3��Һ�е�������������
D. ���е����ʵ�����KOH��Ba(OH)2�Ļ����Һ��ͨ��CO2��������ʧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�Ȼ�ѧ����ʽC2H2(g)+ ![]() O2(g)=2CO2(g)+H2O(g)�� ��H=-1256 kJ��mol-1������˵����ȷ����
O2(g)=2CO2(g)+H2O(g)�� ��H=-1256 kJ��mol-1������˵����ȷ����
A. ��Ȳ��ȼ����Ϊ1256 kJ��mol-1
B. ������2molˮ��������ų�������Ϊ2512 kJ��mol-1
C. ��ת��10mol���ӣ�������2.5molO2
D. ���γ�4mol̼�����õ��Ӷԣ���ų�������Ϊ2512kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����м��������е���
A. ��ˮ�����Ҵ����ױ����屽
B. ��ȼ�շ������Ҵ����������Ȼ�̼
C. ��̼������Һ�����Ҵ����������������
D. �����Ը��������Һ���𱽡�����ϩ�ͻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ö���ȩH��һ����Ҫ�����ϣ���Ҫ����ʳƷ����ױƷ�ȹ�ҵ�С����л���AΪԭ�Ͽ��Ժϳ��ö���ȩH����ϳ�·����ͼ��ʾ�������л���A�ĺ˴Ź�������ֻ��һ��壺

�м����D��һ�־�ϸ������Ʒ�����������ϣ��ܷ������·�Ӧ��

��֪��I��ȩ���Ԫ�������Ҷ������ɷ������·�Ӧ�� ![]()
��. ![]()
��ش�
��1��D�Ľṹ��ʽΪ________��E�к��еĹ���������Ϊ_________��
��2��A�뷴Ӧ��a��AlCl3���µõ�B���÷�ӦԴ�ڹ�ҵ���ұ�����Ӧ��aΪ__________��д���ṹ��ʽ�����÷�Ӧ�ķ�Ӧ����Ϊ________________________
��3����C��D��Ҫ������Ӧ��������д����Ӧ����_____________________________
��4��F��G�ķ�Ӧ����___________�� G��H�Ļ�ѧ����ʽΪ____________________________��
��5���ö���ȩH�еĺ����������ױ����������ɻ�����W��G��W�ɷ���������Ӧ��д��G��W��Ӧ�Ļ�ѧ����ʽ_____________________________________________��
��6��д����W��Ϊͬ���칹���ҷ���������������ͬ���칹��Ľṹ��ʽ________
a�����ڷ����廯�����ұ�����������ȡ����
b��1 mol��������������2molNaOH
c���ܷ���������Ӧ
d���˴Ź���������5��壨���Ϊ12:2:1:2:1��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com