
 H=-1266.8kJ·mol-1
H=-1266.8kJ·mol-1 H=180.5kJ·mol-1
H=180.5kJ·mol-1
 H=-905.8kJ·mol-1。
H=-905.8kJ·mol-1。 H=-1266.8kJ·mol-1,
H=-1266.8kJ·mol-1, H=180.5kJ·mol-1,根据盖斯定律:①+②×2得氨高温催化氧化的热化学方程式为4NH3(g)+5O2(g)===4NO(g)+6H2O(g)
H=180.5kJ·mol-1,根据盖斯定律:①+②×2得氨高温催化氧化的热化学方程式为4NH3(g)+5O2(g)===4NO(g)+6H2O(g)  H=-905.8kJ·mol-1。(2)氨气、空气可以构成燃料电池,其电池反应原理为4NH3+3O2===2N2+6H2O。为减少氨气的溶解损失,则原电解质溶液显碱性,负极的电极反应式为2NH3+6OH-—6e-===N2+6H2O。(3)①由上表数据可知该反应为放热反应,理由是随着温度的升高,平衡常数减小;②合成氨的反应正向为气体体积减小的放热反应,为了增大平衡时H2的转化率,需使平衡正向移动,a.增大压强,平衡正向移动,正确;b.使用合适的催化剂,平衡不移动,错误; c.升高温度,平衡逆向移动,错误;d.及时分离出产物中的NH3,平衡正向移动,正确,选ad ;③利用Q与K的关系判断。400oC时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol·L-1、2mol·L-1、1mol·L-1时,此时刻Q=4.5,K=0.5,Q>K,反应逆向进行,v正(N2)<v逆(N2)。 (4)①根据电荷守恒有c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于c(NH4+)=c(Cl-),故c(H+)=c(OH-),溶液呈中性,故溶液中c(OH-)=10-7mol/L,溶液中c(NH4+)=c(Cl-)=1/2×0.1mol?L-1=0.05mol?L-1,故混合后溶液中c(NH3.H2O)=1/2amol?L-1-0.05mol?L-1=(0.5a-0.05)mol/L,NH3?H2O的电离常数Kb=10?7×0.05/0.5a-0.05=10?8/a-0.1;②盐酸与氨水反应可能出现三种情况:Ⅰ、盐酸过量,体系为NH4Cl和HCl溶液:a盐酸过量的较多(即开始向酸液中滴加氨水)时,c(Cl-)>c(H+)>c(NH4+)>c(OH-);b盐酸稍稍过量时:c(Cl-)>c(NH4+)>c(H+)>c(OH-);Ⅱ、两者恰好完反应,体系为NH4Cl溶液:c(Cl-)>c(NH4+)>c(H+)>c(OH-);Ⅲ、氨水过量:体系为NH4Cl溶液和NH3.H2O:a氨水稍过量时,溶液呈中性:c (Cl-)=c(NH4+)>c(H+)=c(OH-);b氨水稍稍过量时,溶液呈中性以前:c(NH4+)>c(Cl-)>c(H+)>c(OH-);c氨水过量较多时,溶液呈碱性:c(NH4+)>c(Cl-)>c(OH-)>c(H+)或c(NH4+)>c(OH-)>c(Cl-)>c(H+),综上所述,不可能出现c(OH-)>c(NH4+)>c(H+)>c(Cl-),选d。
H=-905.8kJ·mol-1。(2)氨气、空气可以构成燃料电池,其电池反应原理为4NH3+3O2===2N2+6H2O。为减少氨气的溶解损失,则原电解质溶液显碱性,负极的电极反应式为2NH3+6OH-—6e-===N2+6H2O。(3)①由上表数据可知该反应为放热反应,理由是随着温度的升高,平衡常数减小;②合成氨的反应正向为气体体积减小的放热反应,为了增大平衡时H2的转化率,需使平衡正向移动,a.增大压强,平衡正向移动,正确;b.使用合适的催化剂,平衡不移动,错误; c.升高温度,平衡逆向移动,错误;d.及时分离出产物中的NH3,平衡正向移动,正确,选ad ;③利用Q与K的关系判断。400oC时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol·L-1、2mol·L-1、1mol·L-1时,此时刻Q=4.5,K=0.5,Q>K,反应逆向进行,v正(N2)<v逆(N2)。 (4)①根据电荷守恒有c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于c(NH4+)=c(Cl-),故c(H+)=c(OH-),溶液呈中性,故溶液中c(OH-)=10-7mol/L,溶液中c(NH4+)=c(Cl-)=1/2×0.1mol?L-1=0.05mol?L-1,故混合后溶液中c(NH3.H2O)=1/2amol?L-1-0.05mol?L-1=(0.5a-0.05)mol/L,NH3?H2O的电离常数Kb=10?7×0.05/0.5a-0.05=10?8/a-0.1;②盐酸与氨水反应可能出现三种情况:Ⅰ、盐酸过量,体系为NH4Cl和HCl溶液:a盐酸过量的较多(即开始向酸液中滴加氨水)时,c(Cl-)>c(H+)>c(NH4+)>c(OH-);b盐酸稍稍过量时:c(Cl-)>c(NH4+)>c(H+)>c(OH-);Ⅱ、两者恰好完反应,体系为NH4Cl溶液:c(Cl-)>c(NH4+)>c(H+)>c(OH-);Ⅲ、氨水过量:体系为NH4Cl溶液和NH3.H2O:a氨水稍过量时,溶液呈中性:c (Cl-)=c(NH4+)>c(H+)=c(OH-);b氨水稍稍过量时,溶液呈中性以前:c(NH4+)>c(Cl-)>c(H+)>c(OH-);c氨水过量较多时,溶液呈碱性:c(NH4+)>c(Cl-)>c(OH-)>c(H+)或c(NH4+)>c(OH-)>c(Cl-)>c(H+),综上所述,不可能出现c(OH-)>c(NH4+)>c(H+)>c(Cl-),选d。

科目:高中化学 来源:不详 题型:填空题
 (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1 NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3

| A.NH4Cl | B.Na2CO3 | C.HOCH2CH2OH | D.HOCH2CH2NH2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g)+H2(g)反应的平衡常数和温度的关系如下:
CO2(g)+H2(g)反应的平衡常数和温度的关系如下:| |温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
 ΔH=+8.0kJ·mol-1
ΔH=+8.0kJ·mol-1 ΔH=+90.4kJ·mol-1
ΔH=+90.4kJ·mol-1 ΔH=-556.0kJ·mol-1
ΔH=-556.0kJ·mol-1 ΔH=-483.6kJ·mol-1
ΔH=-483.6kJ·mol-1 与
与 反应生成
反应生成 热化学方程式 。
热化学方程式 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白:
xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/(mol/L) | 6 | 3 | 2 | 2 |
| c(B)/(mol/L) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol/L) | 1 | 2.5 | 3 | 3 |
 2C
2C查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题


 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
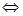 CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,| 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |
| K | 2.50 | 0.34 | 0.15 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 CO(g)+H2(g);
CO(g)+H2(g); H2(g)+CO2(g)。
H2(g)+CO2(g)。 CO2(g)+H2(g)达到化学平衡状态的依据是________。(多选、漏选、错选均不得分)
CO2(g)+H2(g)达到化学平衡状态的依据是________。(多选、漏选、错选均不得分) 2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。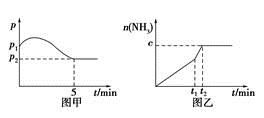
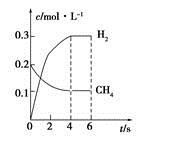
 CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如右图所示:0~4 s内,用CO(g)表示的反应速率为____________。
CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如右图所示:0~4 s内,用CO(g)表示的反应速率为____________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com