
【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124形式存在于溶液中。“废渣2”中含有_______。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124![]() R4V4O12+4OH(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”、“碱”或“中”)。
R4V4O12+4OH(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”、“碱”或“中”)。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
【答案】(1)V2O5+2H+=2VO2++H2O;SiO2;
(2)0.5;(3)Fe(OH)3、Al(OH)3;
(4)碱;(5)K+ ;(6)2NH4VO3![]() V2O5+H2O+2NH3↑。
V2O5+H2O+2NH3↑。
【解析】(1)“酸浸”时V2O5转化为VO2+,V元素化合价不变,说明不是氧化还原反应,根据原子守恒可知反应的离子方程式为V2O5+2H+=2VO2++H2O;二氧化硅与酸不反应,则“废渣1”的主要成分是二氧化硅。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,V元素化合价从+4价升高到+5价,而氧化剂KClO3中氯元素化合价从+5价降低到-1价,则根据电子得失守恒可知需要氯酸钾的物质的量为3 mol÷6=0.5 mol。
(3)“中和”作用之一是使钒以V4O124形式存在于溶液中,同时生成氢氧化铁、氢氧化铝沉淀,则“废渣2”中含有Fe(OH)3、Al(OH)3。
(4)根据方程式可知为了提高洗脱效率,反应应该向逆反应方向进行,因此淋洗液应该呈碱性。
(5)由于前面加入了氯酸钾和氢氧化钾,则“流出液”中阳离子最多的是钾离子。
(6)根据原子守恒可知偏钒酸铵(NH4VO3)“煅烧”生成七氧化二钒、氨气和水,发生反应的化学方程式为2NH4VO3![]() V2O5+H2O+2NH3↑。
V2O5+H2O+2NH3↑。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.浓溶液的导电能力一定很强
B.胶体带有同种电荷
C.离子反应中必有离子的数目在改变
D.氧化剂和还原剂不可能是同一种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | ll.l | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是__________。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗172.8g Cr2O72-转移4.8 mol e-,该反应离子方程式为________________。
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应是Fe-2e-==Fe2+,阴极反应式是2H++2e-==H2↑。

(1)电解时能否用Cu电极来代替阳极上的Fe电极?________(填“能”或“不能”),理由是______________。
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为______________。
(3)上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡影响角度解释其原因_________________。
(4)若溶液中初始含有0.1mol Cr2O72-,则生成的阳离子全部转化化成沉淀的质量是________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下的恒容容器发生可逆反应:2A(g)+2B(g)![]() 3C(g)+D(g),反应达化学平衡的标志是( )
3C(g)+D(g),反应达化学平衡的标志是( )
A. 单位时间内生成n mol A,同时生成n mol D
B. B的浓度保持不变
C. 容器内混合气体的密度不随时间而变化
D. 单位时间内消耗n mol B,同时消耗n mol A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏钒酸铵(NH4VO3)主要用作催化剂、催干剂、媒染剂等。用沉淀法除去工业级偏钒酸铵中的杂质硅、磷的流程如下:
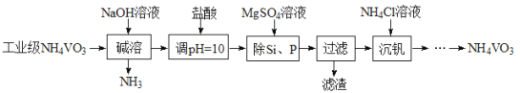
(1)碱溶时,下列措施有利于NH3逸出的是_____(填字母)。
A.升高温度 B.增大压吸 C.增大NaOH溶液的浓度
(2)①滤渣的主要成分为Mg3(PO4)2、MgSiO3,已知Ksp(MgSiO3)=2.4×l0-5.若滤液中c(SiO32-)=0.08mol/L,则c(Mg2+)=__________。
②由图可知,加入一定量的MgSO4溶液作沉淀剂时,随着温度的升高,除磷率下降,其原因是温度升高,Mg3(PO4)2溶解度增大和_______;但随着温度的升高,除硅率升高,其原因是______(用离子方程式表示)。

(3)沉钒时,反应温度需控制在50℃,在实验室可采取的加热方式为_______。
(4)探究NH4Cl的浓度对沉钒率的影响,设计实验步骤(常见试剂任选):取两份10mL一定浓度的滤液A和B,分别加入lmL和10mL的1mol/LNH4Cl溶液,再向A中加入_______mL蒸馏水,控制两份溶液温度均为50℃、pH均为8,由专用仪器洲定沉钒率。加入蒸馏水的目的是______。
(5)偏钒酸铵本身在水中的溶解度不大,但在草酸(H2C2O4)溶液中因发生氧化还原反应而溶解,同时生成络合物(NH4)2[(VO)2(C2O4)3],该反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是( )

A. 原子半径:r(W)>r(Z)>r( Y)>r(X)
B. Y元素的单质只能跟酸反应
C. 最简单气态氢化物的热稳定性:W>Z
D. W元素氧化物对应的水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①H2O ②石墨 ③NH4NO3 ④液态氯化氢⑤冰醋酸 ⑥蔗糖属于强电解质的是;属于弱电解质的是;属于非电解质的是(用编号填写).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com