

“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂。其中没食子儿茶素(EGC)的结构如下图所示。关于EGC的下列叙述中不正确的是( )
A. EGC分子中所有的原子一定不共面
B. 1molEGC与3molNa恰好完全反应
C. EGC可以发生氧化反应和取代反应,1mol该物质可以与6molH2发生加成反应
D. 1mol EGC可以与2molBr2发生取代反应
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
在铝与稀硫酸的反应中,已知10 s末硫酸的浓度减少了0.6 mol·L-1,若不考虑反应过程中溶液体积的变化,则10 s内生成硫酸铝的平均反应速率是
A.0.02 mol·L-1·min-1
B.1.8 mol·L-1·min-1
C.1.2 mol·L-1·min-1
D.0.18 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就三大酸与金属铜反应的情况,回答下列问题:
(1)稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解。该反应的化学方程式为:____________________________________。
(2)在一定体积的10 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积_________(填“大于”、“等于”或“小于”)100ml。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为__________________________________________。
(3)根据下图操作及现象推断酸X为______________(填选项)。
a、浓盐酸 b、浓硫酸 c、浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
萤火虫发光原理如下:
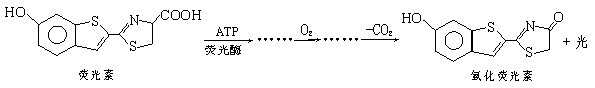
关于荧光素及氧化荧光素的叙述,正确的是( )
A. 均可与溴水发生取代,且均消耗3molBr2 B. 荧光素有酸性、氧化荧光素无酸性
C. 均可与碳酸钠溶液反应 D.均最多有7个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列说法正确的是( )
A.1 mol NaHSO4晶体中离子总数为3NA
B.2.24 L 14CH4分子中所含中子数为0.8NA
C.0.1 L 3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3NA
D. 常温常压下,16gO2和O3混合气体含有NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列溶液中有关物质的量浓度关系和计算不正确的是( )
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:
c(NH4Cl) ﹥c[(NH4)2SO4]﹥c[(NH4)2Fe(SO4)2]
B.已知25°C时Ksp(AgCl)=1.8×10-10,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10mol·L-1
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH约为1
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有C(HA-) >C(H+)>C(A2-)>C(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:
二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,反应的化学方程式及装置图(部分装置省略)如下:
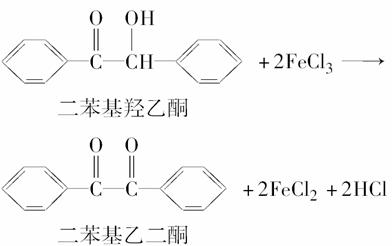

在反应装置中,加入原料及溶剂,搅拌下加热回流。反应结束后加水煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶液重结晶提纯。重结晶过程:
加热溶解―→活性炭脱色―→趁热过滤―→冷却结晶―→抽滤―→洗涤―→干燥
请回答以下问题:
(1)写出装置图中玻璃仪器的名称:
a____________,b____________。
(2)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体:________。
A.缓慢冷却溶液 B.溶液浓度较高
C.溶质溶解度较小 D.缓慢蒸发溶剂
如果溶液发生过饱和现象,可采用________、______等方法促进晶体析出。
(3)抽滤所用的滤纸应略________(填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。烧杯中的二苯
基乙二酮晶体转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是________。
A.无水乙醇 B.饱和氯化钠溶液
C.70%乙醇水溶液 D.滤液
(4)上述重结晶过程中的哪一步操作除去了不溶性杂质:________。
(5)某同学采用薄层色谱(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始、回流15 min、30 min、45 min和60 min时,用毛细管取样、点样,薄层色谱展开后的斑点如下图所示。该实验条件下比较合适的回流时间是________。
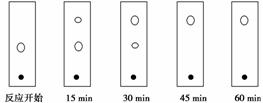
A.15 min B.30 min
C.45 min D.60 min
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com