
【题目】50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是_______。
(2)烧杯间填满碎纸条的作用是_________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值________。(填“偏大”、“偏小”、“无影响”)
(4)实验中改用60mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_____________(填“相等”、“不相等”),所求中和热_____________,(填“相等”、“不相等”),简述理由________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会_______________;用50mL0.50mol·L-1H2SO4溶液进行上述实验,测得的中和热的数值会_____________。(均填 “偏大”、“偏小”、“无影响”)。
【答案】 环形玻璃搅拌棒 减少实验过程中的热量损失 偏小 不相等 相等 因为中和热是指酸跟碱发生中和反应生成1mol H2O所放出的能量,与酸碱的用量无关 偏小 无影响
【解析】(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,故答案为:减少实验过程中的热量损失;
(3)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(4)反应放出的热量和所用酸以及碱的量的多少有关,如果用60mL0.50mol/L酸盐与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用60ml0.50mol/L酸盐与50mL0.55mol/LNaOH溶液进行反应,测得中和热数值相等,故答案为:不相等;相等;中和热是指稀强酸与稀强碱发生中和反应生成1 mol H2O放出的热量,与酸碱的用量无关;
(5)NH3H2O是弱电解质,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量偏小,用50mL0.50mol·L-1H2SO4溶液进行上述实验,测得的中和热的数值不变,故答案为:偏小;无影响。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】(1)NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g),在25 ℃、101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是______________________。
(2)降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g)![]() N2O4(g) ΔH1 2NO2(g)
N2O4(g) ΔH1 2NO2(g)![]() N2O4(l) ΔH2
N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母)________。
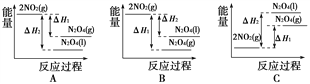
②N2O4与O2、H2O化合的化学方程式是___________________________________。
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa时,1 g甲醇(CH3OH)完全燃烧生成CO2和液态H2O,同时放出22.68 kJ热量。下列表示该反应的热化学方程式中正确的是
A.CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l) ΔH=-725.8 kJ/mol
O2(g)===CO2(g)+2H2O(l) ΔH=-725.8 kJ/mol
B.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=+1 451.6 kJ/mol
C.2CH3OH+3O2===2CO2+4H2O(l) ΔH=-22.68 kJ/mol
D.CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(g) ΔH=-725.8 kJ/mol
O2(g)===CO2(g)+2H2O(g) ΔH=-725.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的描述正确的是( )
A. 有7个周期,18个族
B. 元素种类最多的族为第IIIB族
C. 第IA族元素也称为碱金属元素
D. 现行元素周期表是按照元素的相对原子质量大小排列而成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于恒容密闭容器中发生的可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,能说明反应达到化学平衡状态的为
2NH3(g) ΔH<0,能说明反应达到化学平衡状态的为
A. 断开一个N≡N键的同时有6个N—H键生成
B. 混合气体的密度不变
C. 混合气体的平均相对分子质量不变
D. N2、H2、NH3分子数比为1∶3∶2的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南海争端、南海仲裁案一直牵动国人的心,南海是一个巨大的资源宝库,海水开发利用的部分过程如下图所示。下列有关说法正确的是

A. 第①步中除去粗盐中的SO42-、Ca 2+、Mg2+等杂质,加入药品的顺序为:Na2CO3溶液、NaOH溶液、BaCl2溶液、过滤后加盐酸
B. 第②步的关键要低温小火烘干
C. 氯碱工业的阴极产物是Cl2
D. 从第③步到第⑤步的目的是为了富集溴元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,可逆反应:2NO(g)+O2(g)![]() 2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态.
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明 SO2 具有漂白性的是( )
A. 酸性 KMnO4 溶液中通入 SO2 气体后溶液褪色
B. 滴入酚酞的 NaOH 溶液中通入 SO2 气体红色消失
C. 品红溶液中通入 SO2 气体红色消失
D. 溴水中通入 SO2 气体后溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com