
| A. | 钠保存在煤油中 | |
| B. | 保存碱性溶液的试剂瓶的瓶塞要用橡胶塞 | |
| C. | 硝酸保存到棕色的试剂瓶中,并放置在冷暗处 | |
| D. | 氢氟酸保存到玻璃试剂瓶中 |
科目:高中化学 来源: 题型:选择题
| A. | 它们形成的离子化合物化学式为AB2 | |
| B. | 原子序数:A一定大于B | |
| C. | A和B形成的离子电子层结构一定相同 | |
| D. | A一定是金属,B一定是非金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ω=$\frac{w}{w+V}$×100% | B. | S=$\frac{w}{V}$×100g | ||
| C. | c=$\frac{1000w}{MV}$mol•L-1 | D. | c=$\frac{1000aw}{M(w+V)}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
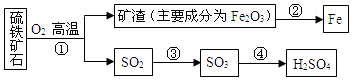
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱酸性溶液中:Na+、Mg2+、HSO3-、ClO- | |
| B. | 0.1mol•L-1氨水溶液中:K+、Na+、NO3-、AlO2- | |
| C. | 与Al反应能放出H2的溶液中:Fe3+、K+、NO3-、SO42- | |
| D. | 0.1 mol•L-1Fe(NO3)3溶液中:H+、Al3+、SO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
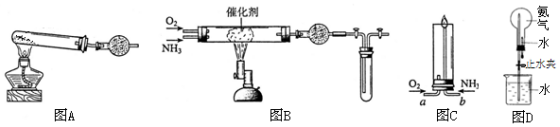
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若将溶液不断加水稀释,则水的电离程度增大 | |
| B. | 溶液中各离子浓度大小关系c(Na+)>c(C2O42-)>c(OH-)>c(H+)>c(HC2O4-) | |
| C. | 若用pH计测得溶液的pH=a,则H2C2O4的第二级电离平衡常数Ka2=1013-2a | |
| D. | 向溶液中加入等体积CaCl2溶液,当加入的CaCl2溶液浓度大于2.4×10-8mol/L时即能产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种物质反应,不管怎样书写化学方程式,平衡常数不变 | |
| B. | 水的离子积常数Kw与温度无关 | |
| C. | 溶液中c(Ag+)•c(Cl-)大于Ksp时,将产生AgCl | |
| D. | 难溶电解质AB2饱和溶液中,c(A2+)=xmol/L,c(B-)=ymol/L,则Ksp值为xy |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为KNO3和NaCl的溶解度曲线,请回答下列问题:
如图为KNO3和NaCl的溶解度曲线,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com