
【题目】燃料电池是目前电池研究的热点之一,现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极。下列叙述正确的是
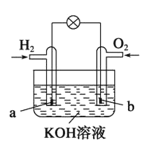
A.总反应方程式为2H2+O2![]() 2H2O
2H2O
B.a极反应是H2-2e-=2H+
C.使用过程中电解质溶液的pH逐渐减小
D.b电极是正极,该电极上发生氧化反应
科目:高中化学 来源: 题型:
【题目】第三代半导体材料氮化镓(GaN)适合于制作高温、高频、抗辐射及大功率器件,通常称为高温半导体材料。回答下列问题:
(1)基态Ga原子价层电子的轨道表达式为_______,第一电离能介于N和B之间的第二周期元素有_______种。
(2)HCN分子中σ键与π键的数目之比为_______,其中σ键的对称方式为______。与CN-互为等电子体的分子为__________。
(3)NaN3是汽车安全气囊中的主要化学成分,其中阴离子中心原子的杂化轨道类型为_________,NF3的空间构型为_________。
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体硅类似,熔点如表所示,分析其变化原因_____________。
GaN | GaP | GaAs | |
熔点 | 1700℃ | 1480℃ | 1238℃ |
(5)GaN晶胞结构如图所示:晶胞中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为_________;


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯达莫司汀是一种抗癌药物。其中一种合成苯达莫司汀中间体H的路线如图:

已知:RCH== CHR’![]() RCOOH+R’COOH
RCOOH+R’COOH
(1)C的命名是____,H中含氧官能团是___(填名称)。
(2)E的结构简式是______,C到D的反应类型是______。
(3)写出B→C的化学方程式:______。
(4)M是 的同分异构体,M能发生银镜反应,和NaHCO3反应产生气体,M可能有___种,若分子中只有3种不同化学环境的氢,则符合条件的M的结构简式是_____。
的同分异构体,M能发生银镜反应,和NaHCO3反应产生气体,M可能有___种,若分子中只有3种不同化学环境的氢,则符合条件的M的结构简式是_____。
(5)请写出以![]() 和适当的无机试剂为原料制备
和适当的无机试剂为原料制备![]() 的合成路线流程图:_____。
的合成路线流程图:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:

回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。

a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积为2 L的密闭容器中加入2 molA和3 molB,保持温度为30℃,在催化剂存在的条件下进行下列反应:2A(g)+3B(g) ![]() 3C(g),2分钟达到平衡,生成1.5 mol C,此时,平衡混合气中C的体积分数为ω1;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol,体积分数为ω2,请回答下列问题,
3C(g),2分钟达到平衡,生成1.5 mol C,此时,平衡混合气中C的体积分数为ω1;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol,体积分数为ω2,请回答下列问题,
(1)该反应在30℃时平衡常数K1=_________ ,焓变△H_______0(填“>”、“<”或“=”)。
(2)从反应开始到达到化学平衡状态v(A)____________mol/(L·min)
(3)该反应在70℃时平衡常数为K2,则 K1_______K2(填“>”、“=”或“<”)
(4)可以判断2A(g)+3B(g) ![]() 3C(g) 反应已经达到平衡(____)
3C(g) 反应已经达到平衡(____)
A.2v(B)=3v(A)
B.密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变
D.混合气体的平均相对分子质量不再改变
E.n(A)∶n(B)∶n(C)=2∶3∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
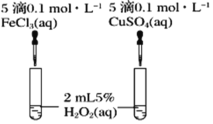
【题目】化学反应速率与限度与生产、生活密切相关
(1)A学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 688 | 810 | 860 |
①反应速率最大的时间段是____________(填0~1、1~2、2~3、3~4、4~5)min,原因是____________。
②在2~3min时间段以盐酸的浓度变化来表示的反应速率为____________。(设溶液体积不变)
(2)B学生也做同样的实验,但由于反应太快,测不准氢气体积,故想办法降低反应速率,请你帮他选择在盐酸中加入下列____________以减慢反应速率。(填写代号)
A.冰块B.HNO3溶液C.CuSO4溶液
(3)C同学为了探究Fe3+和Cu2+对H2O2分解的催化效果,设计了如图所示的实验。可通过观察___________________________现象,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是__________________________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为金属单质,下列物质相互转化如图所示:

试回答:
(1)写出B的化学式_______,D的化学式______。
(2)写出由E转变成F的化学方程式______。
(3)检验G溶液中阳离子的试剂为______,写出发生反应的离子方程式______。
(4)向G溶液加入A的有关离子反应方程式______。
(5)某同学取B的溶液酸化后加入碘化钾淀粉溶液,在空气中放置一会儿变为蓝色,写出与上述变化过程相关的离子方程式______,______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,分别对反应C(s)+CO2(g)![]() 2CO(g)(ΔH>0)进行如下操作(只改变该条件):①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应速率显著变大的是
2CO(g)(ΔH>0)进行如下操作(只改变该条件):①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应速率显著变大的是
A.①②③④B.①③④C.①②D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应X(g)+2Y(g)![]() Z(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(X)=0.100mol·L-1,c(Y)=0.200mol·L-1,c(Z)=0mol·L-1。反应物X的浓度随时间的变化如图所示。下列说法正确的是
Z(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(X)=0.100mol·L-1,c(Y)=0.200mol·L-1,c(Z)=0mol·L-1。反应物X的浓度随时间的变化如图所示。下列说法正确的是
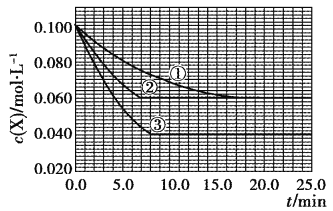
A. 实验②的温度高于实验①的温度
B. 实验②平衡时Y的转化率为60%
C. 实验③与实验①相比,实验③使用了催化剂
D. 反应X(g)+2Y(g)![]() Z(g)的△H>0
Z(g)的△H>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com