
| A. | 加水稀释后所有的离子浓度均减小 | |
| B. | 与等体积等浓度的盐酸反应后,有:c(NH3.H2O)+c(OH-)=c(H+) | |
| C. | 加入等浓度的盐酸到pH=7时,有:c(NH4+)+c(NH3.H2O)=c(Cl-) | |
| D. | 该溶液在与盐酸完全中和的过程中,H2O的电离度不断增大 |
分析 A.稀释过程中氢氧根离子浓度减小,由于水的离子积不变,则氢离子浓度增大;
B.与等体积等浓度的盐酸反应后,两溶液恰好反应生成氯化铵,根据氯化铵溶液中的质子守恒判断;
C.溶液的pH=7,为中性溶液,则c(OH-)=c(H+),结合电荷守恒判断c(NH4+)与c(Cl-)大小;
D.氨水中氢氧根离子浓度越小,则水的电离程度越大,该溶液在与盐酸完全中和的过程中,氢氧根离子浓度逐渐减小,则水的电离程度逐渐增大
解答 解:A.加水稀释时,促进一水合氨电离,但是溶液中氢氧根离子浓度减小,由于水的离子积不变,则氢离子浓度增大,故A错误;
B.两溶液恰好反应生成氯化铵,根据氯化铵溶液中的质子守恒可知:c(NH3•H2O)+c(OH-)=c(H+),故B正确;
C.溶液的pH=7,则c(OH-)=c(H+),结合电荷守恒可知:c(NH4+)=c(Cl-),故C错误;
D.氨水中氢氧根离子浓度越小,则水的电离程度越大,该溶液在与盐酸完全中和的过程中,氢氧根离子浓度逐渐减小,则水的电离程度逐渐增大,故D正确;
故选BD.
点评 本题考查离子浓度大小比较,题目难度中等,明确弱电解质的电离平衡及其影响为解答关键,注意掌握电荷守恒、物料守恒及质子守恒的含义及应用方法,A为易错点,注意温度不变,电离平衡常数不变,试题侧重基础知识的考查,培养了学生的灵活应用能力.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | NO2、CO、CO2均为酸性氧化物 | |
| B. | ${\;}_{8}^{16}$O2和${\;}_{8}^{18}$O2的质子数相同,互为同位素 | |
| C. | 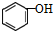 与 与 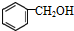 互为同系物 互为同系物 | |
| D. | 淀粉、纤维素和蛋白质都属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S的电子式: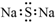 | |
| B. | HClO的结构式:H-O-Cl | |
| C. | 2,2-二甲基丙烷的结构简式: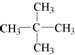 | |
| D. | 氯离子结构示意图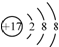 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某化学兴趣小组设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质,下列说法不正确的是( )
某化学兴趣小组设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质,下列说法不正确的是( )| A. | 利用I、II装置制取气体(K2关闭、K1打开),可以收集H2等气体,但不能收集02、NO气体 | |
| B. | 利用II装置作简单改进(但不改变瓶口朝向)后,可以收集O2、NO等气体,但不能收集NO2气体 | |
| C. | 利用I、Ⅲ装置可以比较H2S04、H2CO3和H2SiO3的酸性强弱 | |
| D. | 利用I、Ⅲ装置既能验证氧化性:Ca(ClO)2>Cl2>Br2,又能保护环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②⑤ | C. | ③④ | D. | ④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若向溶液F中加入K4[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液F中含有Fe2+ | |
| B. | 溶液N为深蓝色,说明溶液N中含大量Cu2+ | |
| C. | 合金样品中Cu的质量分数为$\frac{a-b-c}{a}$×100% | |
| D. | 合金样品中Al的质量分数为$\frac{9c}{17a}$×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
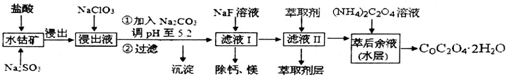
| 沉淀物 | Fe(OH)3 | Al(OH)3 | co(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
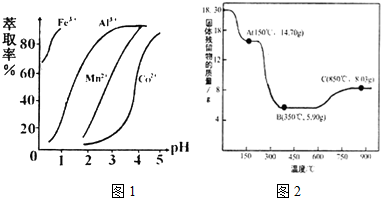
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com