
 NA
NA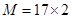 ,解得M=34,所以X原子的相对原子质量是34-m。
,解得M=34,所以X原子的相对原子质量是34-m。 可知,X的相对原子质量可表示为
可知,X的相对原子质量可表示为 NA。
NA。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.W=181.8 |
| B.此过程中,水被还原,共得到0.1NA个电子 |
| C.所得溶液中溶质质量分数约为2.174% |
| D.仅据上述条件无法求算所得溶液的物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硫酸的摩尔质量是98 g |
| B.1 mol水的质量是18 g·mol-1 |
| C.氯化氢的摩尔质量在数值上等于它的相对分子质量 |
| D.22 g二氧化碳的物质的量是0.5 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.6.25mol·L-1 | B.12.5mol·L-1 | C.7mol·L-1 | D.7.5mol·L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一定温度和压强下,各种气态物质的体积大小,由构成气体的分子大小决定 |
| B.一定温度和压强下,各种气态物质的体积大小由构成气体的分子数决定 |
| C.非标准状况下,1 mol任何气体的体积不可能为22.4 L |
| D.将0.5mol气体A和0.5mol气体B混合,在标准状况下的体积一定约为22.4 L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| A.量取浓硫酸时,仰视读数 |
| B.洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中 |
| C.稀释硫酸时,有溶液溅到桌面上 |
| D.没有洗涤稀释硫酸的烧杯和玻璃棒 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L |
| B.从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液的浓度为1 mol/L |
| C.配制480 mL 0.5 mol/L的CuSO4溶液,需62.5 g胆矾 |
| D.10 g 98%的硫酸(密度为1.84 g·cm-3)与10 mL18.4 mol·L-1的硫酸的浓度不同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.⑥③⑧⑤①② | B.③①⑨② | C.④⑤③②①⑨ | D.⑥⑤①③② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com