
铁的氧化物可用于脱除煤气中的H2S,该反应原理为:
①Fe3O4
(s)+3H2S(g)+H2 (g) 3FcS(s)+4H2O(g)
△H=a kJ • mol-1
3FcS(s)+4H2O(g)
△H=a kJ • mol-1
②Fe2O3(s)+2H2S(g)
+ H2(g) 2FeS(s)+3H2O(g)
△H=bkJ • mol-1
2FeS(s)+3H2O(g)
△H=bkJ • mol-1
③FeO(s)+H2S(g)  FeS(s)+H2O(g)
△H=ckJ· mol-1
FeS(s)+H2O(g)
△H=ckJ· mol-1
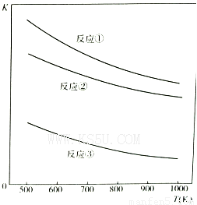
温度与平衡常数的关系如图,下列有关说法正确的是

A.a、b、c均小于0
B.压强越大,H2S的脱除率越高
C.温度越高,H2S的脱除率越高
D.反应①、②、③的平衡常数表达式相同
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014学年浙江省杭州市高三第一次高考科目教学质量检测化学试卷(解析版) 题型:选择题
铁的氧化物可用于脱除煤气中的H2S,有关反应原理如下:
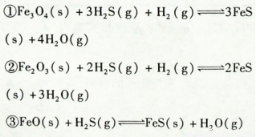
温度与上述各反应的平衡常数的关系如图所示。下列有关说法正确的是
A.反应①、②、③中铁的氧化物都是氧化剂???????????
B.反应①、②、③的正反应都是放热反应
C.反应①、②、③中,温度越高H2S的的脱除率越高???
D.反应①、②、③中,压强越大H2S脱除率越高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com