
【题目】298 K时,各反应的平衡常数如下:
①N2(g)+O2(g)![]() 2NO(g),K=1×10-30;
2NO(g),K=1×10-30;
②2H2(g)+O2(g)![]() 2H2O(g),K=2×1081;
2H2O(g),K=2×1081;
③2CO2(g)![]() 2CO(g)+O2(g),K=4×10-92
2CO(g)+O2(g),K=4×10-92
则常温下,NO、H2O、CO2这三个化合物分解放氧的倾向最大的是( )
A.① B.② C.③ D.无法判断
科目:高中化学 来源: 题型:
【题目】反应A(?)+aB(g)![]() C(g)+2D(g)(a为正整数)。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图所示,下列说法错误的是
C(g)+2D(g)(a为正整数)。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图所示,下列说法错误的是
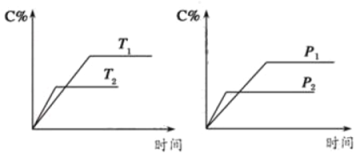
A.若a=2,则A为液态或固体
B.该反应的正反应为放热反应
C.T2>T1,p2>p1
D.其它条件不变,增加B的物质的量,平衡正向移动,平衡常数K增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能促使水的电离平衡正向移动,而且所得溶液呈酸性的是
A. 将水加热到100℃时,水的pH=6 B. 向水中滴加少量NaHSO4溶液
C. 向水中加入少量NH4Cl D. 向水中加入少量碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硝酸钠固体中混有少量硫酸铵和硫酸镁杂质,现设计一实验方案,既除去杂质,又配成硝酸钠溶液。实验方案:先将固体溶于蒸馏水配成溶液,选择合适的试剂和操作完成表格中各步实验。(已知NH4++OH- ![]() NH3↑+H2O)
NH3↑+H2O)
选择试剂 | ① | Na2CO3溶液 | ② |
实验操作 | ③ | ④ | 调节pH |
下列试剂或操作不合理的是
A.试剂①为Ba(OH)2溶液 B.试剂②为稀HNO3
C.操作③为结晶 D.操作为④过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁[Fe3(PO4)2·8H2O]为白蓝色晶体,溶于强酸,不溶于水、醋酸和乙醇。主要用于制造磷酸铁锂电池。实验室制备磷酸亚铁的装置示意图、

反应和实验步骤如下。主要反应为:
3FeSO4+2Na2HPO4+2CH3COONa+8H2O=Fe3(PO4)2·8H2O↓+3Na2SO4+2CH3COOH
实验步骤:①在仪器A中先加入抗坏血酸(C6H8O6)稀溶液作底液②向仪器A中,滴入Na2HPO4与CH3COONa混合溶液至pH=4 ③滴入15.2克FeSO4溶液,最终维持pH=6,充分反应后,静置④进行操作a,干燥得到的磷酸亚铁12.8克。
(1)仪器A的名称是 。
(2)实验中配制FeSO4溶液时,先要对蒸馏水进行的操作是 。
(3)实验中不是将三种溶液直接混合的原因是 ,反应时需不断搅拌,其目的是 。
(4)步骤④进行的操作a是 。
(5)检验磷酸亚铁粗产品中是否混有氢氧化铁杂质的方法是 。
(6)本实验的产率是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关组成生物体化学元素的论述,正确的是()
A. 组成生物体和组成无机自然界的化学元素中,碳元素的含量最多
B. 人、动物与植物所含的化学元素的种类差异很大
C. 组成生物体的化学元素在无机自然界中都可以找到
D. 不同生物体内各种化学元素的含量基本相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4500ml的操作,实验操作如下,
①将配好的稀硫酸倒入试剂瓶中,贴好标签;
②盖好容量瓶塞,反复颠倒摇匀;
③用量筒量取 ml的98% 的浓硫酸;
④将浓硫酸稀释;
⑤用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
⑥将已冷却至室温的硫酸溶液沿玻璃棒注入 __________;
⑦改用__________ 逐滴加蒸馏水,使溶液的____________ 正好跟刻度相平。
⑧继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2cm处;
请完成下列问题:
(1)正确操作步骤的顺序是(填序号)③④ ⑦②①
(2)③中所需浓硫酸的体积 ml,⑥中所需仪器名称是 。
(3)简述④中浓硫酸的稀释方法 。
(4)完成⑦中的填空 、 。
(5)若在操作中没有把少量洗涤烧杯的洗涤液全部转移到容量瓶中,会使稀硫酸溶液的浓度(填“大于”、“小于”或“等于”) 0.5mol/L,配制成稀H2SO4时若加蒸馏水超过了刻度线,倒出一些溶液,再重新加蒸馏水到刻度线,会使稀硫酸溶液的浓度 (填“大于”、“小于”或“等于”) 0.5mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g) +Y(g)![]() 3Z(g) △H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
3Z(g) △H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是

A.升高温度,平衡常数增大
B.W点X的正反应速率小于M点X的正反应速率
C.Q点时,Y的转化率最小
D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种,取该溶液进行连续实验,实验过程如下:

根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是 .能证明该阴离子是否存在的简单实验操作为____ __.
(2)用离子方程表达下列反应:
①中生成气体A: .②中生成溶液H: .
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0ml时开始产生沉淀,55ml时沉淀的量达到最大值0.03mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025mol且保持不变,则原溶液中c(Fe2+)为 mol/L、c(Fe3+)为 mol/L、c(Cl﹣)为 mol/L.(若有些离子不存在,请填0mol/L)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com