
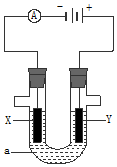
 如图表示一个电解池,如果用电解方法精炼粗铜,电解液a选用硫酸铜溶液,则X电极是纯铜,Y的电极反应式是:Cu-2e-=Cu2+..
如图表示一个电解池,如果用电解方法精炼粗铜,电解液a选用硫酸铜溶液,则X电极是纯铜,Y的电极反应式是:Cu-2e-=Cu2+.. 分析 如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,阳极应该是粗铜、阴极是纯铜,则X电极是纯铜、Y电极是粗铜,阴极上铜离子放电,据此进行解答.
解答 解:X与电源负极相连,为电解池的阴极,Y为电源正极相连,为电解池的阳极;
如果要用电解方法精炼粗铜,电解液a选用CuSO4溶液,阳极应该是粗铜、阴极是纯铜,则X电极是纯铜、Y电极是粗铜,阳极发生反应为:Cu-2e-=Cu2+,
故答案为:纯铜; Cu-2e-=Cu2+.
点评 本题考查电解原理,为高频考点,题目难度不大,侧重于学生的分析能力的考查,明确电解原理为解答关键,注意掌握电极反应式的书写方法,试题培养了学生的灵活应用能力


科目:高中化学 来源: 题型:选择题
| A. | 蒸发时,给蒸发皿内液体加热时,液体不超过容器的$\frac{2}{3}$ | |
| B. | 蒸馏操作时,冷凝管中进冷凝水应是“下进上出” | |
| C. | 盛放NaOH溶液时,使用带橡胶塞的磨口瓶 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1<0 | B. | △H2>0 | C. | △H1=△H3-2△H2 | D. | 2△H4>△H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在烷烃分子中,可能会有碳碳双键 | |
| B. | 烷烃中除甲烷外,很多都能使紫色KMnO4溶液褪色 | |
| C. | 分子通式为CnH2n+2的烃不一定是烷烃 | |
| D. | 所有的烷烃在光照条件下都能与氯气发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ②③④ | C. | ①③⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度为0.5 mol/L的MgCl 2溶液中,共含有Cl - 个数为 N A | |
| B. | 1mol任何气体的体积都为 22.4L | |
| C. | 7.8gNa 2O 2中所含阴离子的数目是0.1N A | |
| D. | 标准状况下,2.24L水中含有的分子数为0.1N A |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取碳酸钠晶体(Na2CO3•10H2O)100g来配制0.5mol/L的Na2CO3溶液1000mL | |
| B. | 配制NH3NO3溶液,在烧杯中溶解后立即注入容量瓶,并立即进行下面的各项操作 | |
| C. | 定容后,将容量瓶振荡均匀,静置时发现液面低于刻度线,于是又加入少量水至刻度线 | |
| D. | 容量瓶用蒸馏水洗净后未经干燥马上用来配制溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com