
(1)实验室用二氧化锰跟浓盐酸反应制取氯气的离子方程式为 。
(2)高锰酸钾是常用氧化剂,在酸性条件下,MnO4-被还原成Mn2+,用高锰酸钾跟浓盐酸反应在室温下制氯气的离子方程式为 。
(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气,反应的化学方程式为 。
(4)现有100 mL AlCl3与MgSO4的混合溶液,分成两等份。
① 向其中一份中加入10 mL 4 mol/L的氨水,恰好完全沉淀,其中AlCl3与氨水反应的离子方程式是 。继续加入1 mol/L NaOH溶液至10 mL时,沉淀不再减少,沉淀减少的离子方程式是 ,减少的沉淀的物质的量是 。
② 向另一份中加入a mL 1 mol/LBaCl2溶液能使SO42-沉淀完全,a= 。
(14分)(1)MnO2+4H++2Cl-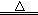 Mn2++Cl2↑+2H2O(2分)
Mn2++Cl2↑+2H2O(2分)
(2)2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O(2分)
(3)4HCl+O2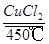 2Cl2↑+2H2O
2Cl2↑+2H2O
(4)①A13+ + 3NH3•H2O=Al(OH)3↓+ 3NH4+ Al(OH)3+ OH-=AlO2-+ 2H2O
0.01 mol
②5
【解析】
试题分析:(1)、实验室常用二氧化锰氧化浓盐酸法制取氯气,在加热时反应生成二氯化锰、氯气和水,化合价升降总数均为2;(2)、高锰酸钾的氧化性比二氧化锰强,常温下能氧化浓盐酸,生成氯化钾、二氯化锰、氯气和水,化合价升降总数均为10;(3)、根据氧化还原反应方程式的配平方法可知,氯化氢气体被氧气催化氧化为氯气和水蒸气,化合价升降总数均为4;(4)、①完全沉淀之前反应式为A13+ + 3NH3•H2O=Al(OH)3↓+ 3NH4+、Mg2++ 2NH3•H2O=Mg(OH)2↓+ 2NH4+;完全沉淀之后,氢氧化铝是两性氢氧化物,能溶于过量的氢氧化钠溶液,生成偏铝酸盐和水,反应式为Al(OH)3+ OH-=AlO2-+ 2H2O;该反应中两反应物的化学计量数之比等于物质的量之比,由于n(OH-)=n(NaOH)=c•V=1mol/L×0.01L=0.01mol,则n[Al(OH)3]=0.01mol;根据铝元素守恒,由此推断原溶液中n( AlCl3)=n[Al(OH)3]=0.01mol,沉淀之前消耗的n(NH3•H2O)=0.03mol;由于n=cV,则完全沉淀总共消耗的n(NH3•H2O)=4mol/L×0.01L=0.04mol,则被MgSO4消耗的n(NH3•H2O)=0.04mol—0.03mol=0.01mol,根据两反应物的化学计量数之比等于物质的量之比,则n(MgSO4)=0.005mol;②另一等份的混合溶液中也含有0.01mol AlCl3、0.005molMgSO4,前者与BaCl2溶液不反应,后者发生的沉淀反应为MgSO4+BaCl2=BaSO4↓+MgCl2,根据两反应物的化学计量数之比等于物质的量之比,则n(BaCl2)=0.005mol;由于V=n/c,则V=0.005mol÷1 mol/L×1000mL/L=5mL,则a=5。
考点:考查离子方程式、氧化还原反应、氢氧化铝的沉淀和溶解、硫酸盐的沉淀反应的计算等相关知识。


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
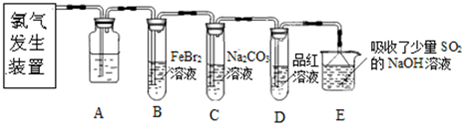
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| CuCl2 | ||
|
| CuCl2 | ||
|
查看答案和解析>>
科目:高中化学 来源: 题型:
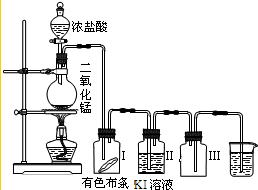 某同学实验室用下列装置探究氯气的性质.
某同学实验室用下列装置探究氯气的性质.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com