
【题目】下图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是

A. 金属镁和卤素单质(X2)的反应能自发进行是因为ΔH均小于零
B. 热稳定性: MgI2 > MgBr2 > MgCl2 > MgF2
C. 工业上可由电解MgCl2溶液冶炼金属Mg,该过程需吸收热量
D. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方 程式为:MgBr2(s)+Cl2(g)![]() MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
【答案】A
【解析】根据图像可知,反应物总能量大与生成物总能量,均为放热反应, ΔH均小于零,能自发进行,A正确;反应放热越多,生成的物质越稳定。比较反应热大小可知热稳定顺序为:MgI2 < MgBr2 < MgCl2 <MgF2,B错误;已知由Mg制取MgCl2是放热过程,电解熔融的氯化镁制取镁是吸热过程,而电解氯化镁溶液得不到金属镁,C错误;已知①Mg(s)+Cl2(s)=MgCl2(s)ΔH=-641 kJ·mol-1,②Mg(s)+Br2(s)= MgBr2(s) ΔH=-524kJ·mol-1,![]() 得MgBr2(s)+Cl2(g)
得MgBr2(s)+Cl2(g)![]() MgCl2(s)+Br2(g) ΔH=-117 kJ·mol-1,D错误;正确选项A。
MgCl2(s)+Br2(g) ΔH=-117 kJ·mol-1,D错误;正确选项A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】为测定已部分变质的过氧化钠(假定杂质全部为碳酸钠)的纯度,设计了如下图所示的实验.图中Q为一具有良好弹性的气球(气球不参与反应,也不会被腐蚀),称取一定量的样品放入其中,按图安装的实验装置打开分液漏斗的活塞,将稀硫酸滴入气球中.请填空:
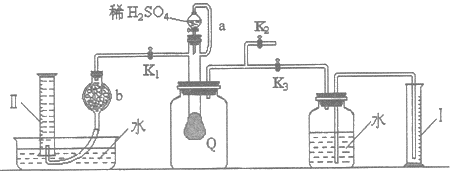
(1)Q内发生反应生成了两种气体,这两种气体的分子式为O2、CO2,写出反应的离子方程式:________。
(2)导管a的作用是________。
(3)为测定反应生成气体的总体积,滴稀硫酸前必须关闭________(填K1、K2、K3,下同),打开________。
(4)当上述反应停止后将K1、K2、K3处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是________。
(5)b中装的固体试剂是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是用98%的浓H2SO4(ρ=1.84 g/cm3)配制500 mL 0.5 mol·L-1的稀硫酸的实验操作,请按要求填空:
(1) 计算所需浓硫酸的体积为________mL(保留一位小数);
(2) 如果实验室有10 mL、20 mL、50 mL的量筒,应选___________规格的量筒最好,如果量取浓硫酸时仰视读数,所配溶液浓度将(填“偏高”、“偏低”或“无影响”)___________;
(3) 将量取的浓硫酸沿烧杯内壁慢慢注入盛有约100 mL水的__里,并不断搅拌,搅拌的目的是_____;
(4) 将冷却至室温的上述溶液沿________注入________中,并用50 mL蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液要转入到容量瓶中,并振荡;
(5) 加水至距刻度线1~2 cm处,改用________加水至刻度线,使溶液的________________恰好跟容量瓶刻度线相平,把容量瓶塞好,反复颠倒振荡,摇匀溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子合物J的合成路线如下:
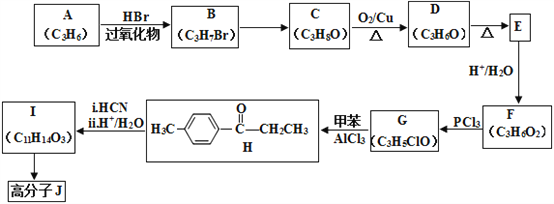
已知:i. 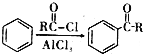
ii. 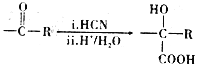
(1)写出A的结构简式:________________________。
(2)由B→C的反应条件为:________________,反应类型为:_________________。
(3)H中官能团名称:________________________。
(4)D 与新制的银氨溶液反应生成E的化学方程式:__________________________________________。
(5)由I合成高分子化合物J的化学方程式为____________________________________。
(6)有机物L(C9H10O3)符合下列条件的同分异构体有___________种。
①与FeCl3溶液发生显色反应
②与I具有相同的官能团
③苯环上有3个取代基,且只有一个烷基
(7)结合上述流程中的信息,设计由![]() 制备
制备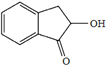 的合成路线。合成路线流程图示例:
的合成路线。合成路线流程图示例:
H2C=CH2![]() CH3CH2OH
CH3CH2OH![]() CH3COOC2H5,______________________。
CH3COOC2H5,______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机合成中间体的结构简式如图所示。下列关于该有机物的叙述不正确的是

A. 分子式为C9H9O4Br
B. 在一定条件下可与HCHO发生缩聚反应
C. 1 mol该物质与足量NaOH溶液混合加热,最多能消耗4mol NaOH
D. 1 mol该物质与浓溴水反应,最多能消耗3mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要配制500mL 0.2mol·L-1的NaOH溶液:请结合实验回答下列问题:
(1)实验中需称量NaOH固体的质量为__________
(2)完成上述实验步骤要用到的玻璃仪器有烧杯、量筒、玻璃棒、__________。
(3)分析下列操作对所配制溶液浓度的影响(填 “偏高”“偏低”或“无影响”)。
①转移液体过程中有少量液体溅出:__________;
②定容时仰视刻度线:__________;
③将NaOH固体溶解后,直接转至容量瓶中进行实验:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与化学概念有关的说法正确的是( )
A.化合反应均为氧化还原反应
B.金属氧化物均为碱性氧化物
C.烧碱、纯碱、熟石灰都是碱
D.BaSO4、NaOH、HNO3都是强电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,向20 mL 0.1 mol·L1 MOH溶液中滴加0.1 mol·L1 CH3COOH溶液, 所得溶液的pH(对应曲线M)及导电能力(对应曲线N)变化如图所示。下列叙述正确的是
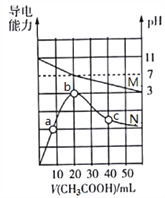
A. MOH是弱碱,其Kb=1.0×1021
B. b点溶液中,c(CH3COO)+ c(CH3COOH)=0.1 mol·L1
C. 水的离子积常数Kw:b>c>a
D. c点溶液中,c(CH3COO)>c(M+)>c(H+)>c(OH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com