
 Pb3O4+O2,
Pb3O4+O2, Pb3O4+O2
Pb3O4+O2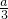 mol
mol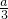 mol×22.4L/mol═
mol×22.4L/mol═ L,
L, L;
L;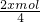 ═
═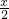 mol;
mol;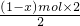 ═(1-x) mol,
═(1-x) mol,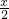 mol+(1-x) mol═(1-
mol+(1-x) mol═(1-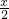 )mol,
)mol,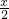 )mol;
)mol;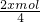 ═
═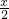 mol,n(Cl2)═
mol,n(Cl2)═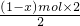 ═(1-x) mol
═(1-x) mol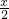 :(1-x)═3:5,
:(1-x)═3:5,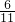 ,
,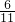 ,含pb4+的物质的量分数为
,含pb4+的物质的量分数为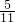 ,即n(pb2+):n(pb4+)═6:5,
,即n(pb2+):n(pb4+)═6:5,

科目:高中化学 来源: 题型:
| ax |
| 2 |
| ax |
| 2 |
| x |
| 2 |
| x |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 22.4a |
| 3 |
| 22.4a |
| 3 |
| x |
| 2 |
| x |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,常温下能氧化浓HCl生成Cl2;PbO2不稳定,随温度升高按下列顺序逐步分解:PbO2→Pb2O3→Pb3O4→PbO。
现将amol PbO2加热分解,收集产生的O2;加热反应后所得固体中,Pb2+占Pb元素的物质的量分数为x;向加热后所得固体中加入足量的浓盐酸,收集产生的Cl2。两步反应中收集的O2和Cl2的物质的量之和为y mol。
(1)若Fe3O4可表示为FeO·Fe2O3,则Pb2O3可表示为
(2)试写出Pb2O3与浓盐酸反应的化学方程式
(3)通过计算确定y与a、x的函数关系式____________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省新马高级中学高二下学期期末考试化学试卷(带解析) 题型:填空题
已知:Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,常温下能氧化浓HCl生成Cl2;PbO2不稳定,随温度升高按下列顺序逐步分解:PbO2→Pb2O3→Pb3O4→PbO。
现将a mol PbO2加热分解,收集产生的O2;加热反应后所得固体中,Pb2+占Pb元素的物质的量分数为x;向加热后所得固体中加入足量的浓盐酸,收集产生的Cl2。两步反应中收集的O2和Cl2的物质的量之和为y mol。
(1)若Fe3O4可表示为FeO·Fe2O3,则Pb3O4可表示为
(2)试写出Pb2O3与浓盐酸反应的化学方程式
(3)通过计算确定y与a、x的函数关系式____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com