
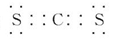
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源:不详 题型:单选题
 ,下列原子中,与氟元素原子的化学性质相似的是( )
,下列原子中,与氟元素原子的化学性质相似的是( ) 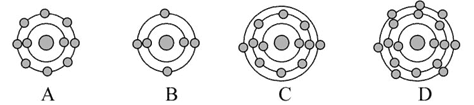
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同主族金属元素原子半径大小 |
| B.1 mol金属单质在反应中失去电子的多少 |
| C.水溶液中金属间发生的置换反应 |
| D.金属元素最高价氧化物对应水化物的碱性强弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.XY | B.XY2 | C.Y3X | D.XY4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氨气在氧气中燃烧生成氮气 | B.沸点:H2O>NH3 |
| C.NO中N为+2价,氧为-2价 | D.热稳定性:H2O>NH3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同主族元素的简单阴离子还原性越强,水解程度越大 |
| B.Na和Cs属于IA族元素,Cs失电子的能力比Na强 |
| C.IA族与VIIA族元素间可形成共价化合物或离子化合物 |
| D.同周期元素(0族元素除外)从左到右,原子半径逐渐减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com