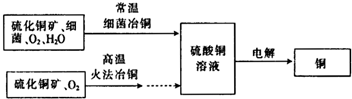
如图为细菌冶铜和火法冶铜的主要流程.
(1)①写出用惰性电极电解硫酸铜溶液的化学方程式:______(电解过程中,始终无氢气产生).
②若电解一定时间后,外加0.1mol的氢氧化铜可使电解液恢复到电解前的浓度,电路中转移电子物质的量______.
(2)细菌冶金又称微生物浸矿,是近代湿法冶金工业上的一种新工艺.细菌冶铜与火法冶铜相比,优点为______(写出一点即可).
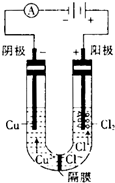
(3)用惰性电极分别电解浓的氯化铜溶液和硫酸铜溶液.电解浓的氯化铜溶液时发现阴极有金属铜生成,同时阴极附近会出现棕褐色溶液.而电解硫酸铜溶液时,没有棕褐色溶液生成.下面是关于棕褐色溶液成分的探究:
①有同学认为,阴极附近出现的棕褐色溶液是氯气反应的结果,你认为他的猜测是否正确?______(填“正确”或“不正确“),原因是______.
资料1:
一般具有混合价态(指化合物中同一元素存在两种不同的化合价,如Fe
3O
4中的Fe元索)的物质的颜色比单一价态的物质的颜色要深.
资料2:
CuCl微溶于水,能溶于浓盐酸.
②猜想:棕褐色溶液中可能含有的离子是______(填3种主要离子符号).
③验证猜想:完成实验方案(配制棕褐色溶液).取少量______固体于试管中,加入______使其溶解,再加入______溶液,观察现象.
④已知电解前,U形管中加入了100mL 0.5mol?L
-1CuCl
2溶液,电解结朿时电路中一共转移了0.03mol电子,且阴极生成0.64g铜,则形成的低价阳离子的物质的量为______mol.





 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案