
铝广泛应用于化学工业和日常生活中。工业上由铝土矿(Al2O3∙3H2O的含量约为85%,其余主要为SiO2、Fe2O3等)冶炼金属铝的流程如下。

已知拜耳法生产Al2O3∙3H2O的基本原理为:
Al2O3∙3H2O+2NaOH(aq) 2NaAlO2(aq)+4H2O,[Al2O3∙3H2O也可表示为2 Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3∙3H2O也可表示为2 Al(OH)3]
(1)操作I的名称为 ,赤泥中除含有铝硅酸盐外,还含有的主要物质有 。
(2)为了提高铝土矿的溶出速率可采取的有效措施为
(任写三点)。
(3)用化学平衡理论解释稀释溶液I有利于Al2O3∙3H2O 结晶的原因____________ 。
(4)为了析出Al2O3∙3H2O,也可向溶液I中通入过量CO2气体,写出生成Al2O3∙3H2O的离子方程式: 。
(5)为了回收赤泥附着液带走的有用成分,工业上将用热水洗涤后的洗液用作溶液I的稀释剂,请指出流程图中另一处类似的做法 。
(16分)
(1)过滤 Fe2O3 (共4分,各2分)
(2)将铝土矿粉碎、加热、搅拌、增大NaOH的浓度(任答三点即得满分)(3分)
(3)稀释降低了NaOH的浓度,有利于NaAlO2或NaAl(OH)4的水解,使平衡向结晶方向移动(或向左移动)(3分)
(4)CO2(过量)+ AlO2-+2H2O = Al(OH)3↓+HCO3- 或
2CO2(过量)+ 2AlO2-+4H2O = Al2O3∙3H2O↓+2HCO3- (3分)
写下列反应也得分:
CO2(过量)+[Al(OH) 4]-= Al(OH)3↓+HCO3- 或
2CO2(过量)+2[Al(OH) 4]-= Al2O3∙3H2O↓+2HCO3- (3分)
(5)将溶液III循环使用溶解铝土矿 (3分)
【解析】
试题分析:(1)铝土矿中Al2O3∙3H2O、SiO2都能溶于过量NaOH溶液中,而Fe2O3是碱性氧化物,不溶于NaOH溶液,过滤是分离固液混合物的常用方法,则操作I为过滤;赤泥中除含有铝硅酸盐外,还含有氧化铁;溶液I的主要成分是偏铝酸钠、硅酸钠、氢氧化钠;(2)根据外界条件对化学反应速率的影响规律,将铝土矿粉碎、加热、搅拌、增大NaOH的浓度等,都能提高铝土矿的浸出速率和浸出率;(3)溶液I中存在如下平衡:Al2O3∙3H2O(s)+2NaOH(aq) 2NaAlO2(aq)+4H2O(l),稀释不仅能减小氢氧化钠的浓度,还能促进NaAlO2的水解,使平衡左移,析出Al2O3∙3H2O(s);(4)碳酸是弱酸,氢氧化铝是两性氢氧化物,则酸性:H2CO3>Al(OH)3,碳酸盐与过量二氧化碳、水能反应生成碳酸氢盐,则溶液I中通入过量二氧化碳气体的反应为CO2(过量)+ AlO2-+2H2O
= Al(OH)3↓+HCO3-或2CO2(过量)+ 2AlO2-+4H2O
= Al2O3∙3H2O↓+2HCO3-、CO2(过量)+[Al(OH)4]-= Al(OH)3↓+HCO3- 、2CO2(过量)+2[Al(OH) 4]-= Al2O3∙3H2O↓+2HCO3-;(5)依题意可知,工业上常采取循环利用的方法,降低能耗、成本,提高生产效率,可以将该化学工艺流程图中溶液III中的NaOH溶液循环使用,用于溶解铝土矿。
2NaAlO2(aq)+4H2O(l),稀释不仅能减小氢氧化钠的浓度,还能促进NaAlO2的水解,使平衡左移,析出Al2O3∙3H2O(s);(4)碳酸是弱酸,氢氧化铝是两性氢氧化物,则酸性:H2CO3>Al(OH)3,碳酸盐与过量二氧化碳、水能反应生成碳酸氢盐,则溶液I中通入过量二氧化碳气体的反应为CO2(过量)+ AlO2-+2H2O
= Al(OH)3↓+HCO3-或2CO2(过量)+ 2AlO2-+4H2O
= Al2O3∙3H2O↓+2HCO3-、CO2(过量)+[Al(OH)4]-= Al(OH)3↓+HCO3- 、2CO2(过量)+2[Al(OH) 4]-= Al2O3∙3H2O↓+2HCO3-;(5)依题意可知,工业上常采取循环利用的方法,降低能耗、成本,提高生产效率,可以将该化学工艺流程图中溶液III中的NaOH溶液循环使用,用于溶解铝土矿。
考点:考查有关物质制备的化学工艺流程大题,涉及解释粉碎固体原料的原因、判断还原剂、根据盖斯定律计算焓变、解释惰性气体的作用、燃料电池的工作原理、正极反应式、溶液pH变化情况等。


科目:高中化学 来源: 题型:
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取。

①步骤Ⅰ中反应的化学方程式为:
4FeO·Cr2O3(s)+8Na2CO3(s)+7O2![]() 8Na2CrO4(s)+2Fe2O3(s)+8CO2
8Na2CrO4(s)+2Fe2O3(s)+8CO2
该反应的化学平衡常数的表达式为____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________。
A.升高温度 B.将原料粉碎
C.增加纯碱的用量 D.通入过量的空气
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是________________________。
③步骤Ⅲ需将溶液的pH调至7—8并煮沸,其目的是_______________________________。
④步骤Ⅳ中发生反应的离子方程式为__________________。
(2)将红矾钠与KCl固体按1∶2(物质的量之比)混合溶于水后经适当操作可得到K2Cr2O7晶体。请填写表中空格,完成上述过程。
序号 | 实验步骤 | 简述实验操作(不必叙述如何组装实验装置) |
① | 溶解 | 将混合物放入烧杯中,加水,充分搅拌直到固体不再溶解 |
② |
|
|
③ |
|
|
④ |
|
|
⑤ | 过滤、干燥 | 得到K2Cr2O7晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
红矾钠(重铬酸钠:Na2Cr2O2·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中用作氧化剂,应用十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)作原料利用以下过程来制取。

①步骤I中反应的化学方程式为:
4FeO·Cr2O3(s)+8Na2CO3(s)+7O2![]() 8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。
8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。
A、升高温度 B、将原料粉碎 C、增加纯碱的用量 D、通入过量的空气
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外,还含有铝、硅元素的化合物,它们的化学式可能是__________。
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是_________________________________。
④步骤Ⅳ中发生反应的离子方程式为______________________________________________。
(2)将红矾钠与KCl固体按1:2(物质的量之比)混合溶于水后经适当操作可得到K2Cr2O7晶体。请填写表中空格,完成上述过程
| 序号 | 实验步骤 | 简述实验操作(不必叙述如何组装实验装置) |
| ① | 溶解 | 将混合物放入烧杯中、加水、充分搅拌直到固体不能溶解 |
| ② | ||
| ③ | ||
| ④ | ||
| ⑤ | 过滤、干燥 | 得到K2Cr2O7晶体 |
查看答案和解析>>
科目:高中化学 来源:2010年四川绵阳高考预测(综合题)化学卷 题型:实验题
(16分)(Ⅰ)下列实验操作或实验叙述正确的是( )
A.可用过滤的方法除去氢氧化铁胶体中少量的氯化铁
B.用酸式滴定管量取18.80mL的碳酸钠溶液
C.配制0.1mol/L的硫酸时,用量筒量取浓硫酸,要洗涤量筒,否则配制的溶液浓度偏低
D.振荡用饱和的碳酸钠溶液吸收乙酸乙酯的试管,发现有气泡冒出,它是CO2气体
E.实验室制取氨气时,常用无水氯化钙进行干燥
(Ⅱ)红矾钠(重铬酸钠:Na2Cr2O2·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中用作氧化剂,应用十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)作原料利用以下过程来制取。
①步骤I中反应的化学方程式为:
4FeO·Cr2O3(s)+8Na2CO3(s)+7O2 8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。
8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。
A、升高温度 B、将原料粉碎 C、增加纯碱的用量 D、通入过量的空气
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外,还含有铝、硅元素的化合物,它们的化学式可能是__________。
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是_________________________________。
④步骤Ⅳ中发生反应的离子方程式为______________________________________________。
(2)将红矾钠与KCl固体按1:2(物质的量之比)混合溶于水后经适当操作可得到K2Cr2O7晶体。请填写表中空格,完成上述过程
| 序号 | 实验步骤 | 简述实验操作(不必叙述如何组装实验装置) |
| ① | 溶解 | 将混合物放入烧杯中、加水、充分搅拌直到固体不能溶解 |
| ② | | |
| ③ | | |
| ④ | | |
| ⑤ | 过滤、干燥 | 得到K2Cr2O7晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
红矾钠(重铬酸钠:Na2Cr2O7?2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO?Cr2O3)利用以下过程来制取。
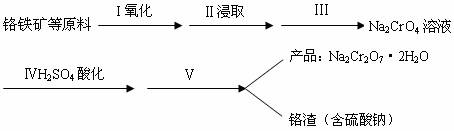
①步骤I中反应的化学方程式为:
![]()
该反应的化学平衡常数的表达式为 ,在常温下该反应速度极慢,下列措施中不能使反应速率增大的是 。
A.升高温度 B.将原料粉碎
C.增加纯碱的用量 D.通入过量的空气
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是 、 。
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是 。
④步骤Ⅳ中发生反应的离子方程式为: 。
(2)将红矾钠与KCl固体按1:2(物质的量之比)混合溶于水后经适当操作可得到K2Cr2O7晶体。请填写表中空格,完成上述过程。
| 序号 | 实验步骤 | 简述实验操作(不必叙述如何组装实验装置) |
| ① | 溶解 | 将混合物放入烧杯中,加水,充分搅拌直到固体不再溶解。 |
| ② | ||
| ③ | ||
| ④ | ||
| ⑤ | 过滤、干燥 | 得到K2Cr2O7晶体。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com