
分析 pH的大小,可以用来表示溶液的酸碱性强弱,碱性越强溶液的pH越大,酸性越强,溶液的pH越小,还可以用氢离子或氢氧根离子浓度判断溶液酸碱性,测定溶液酸碱性一般用pH试纸,还可以用pH计测定溶液pH值.
解答 解:pH=-lgc(H+),所以pH的大小与氢离子浓度大小有关,可用来表示溶液的酸碱性的强弱,溶液的碱性越强,氢离子浓度越小,pH越大;溶液的酸性越强,氢离子浓度越大,pH越小;
当溶液中H+或OH-离子浓度大于1mol/L时,溶液的pH为小数,所以一般不用pH表示溶液的酸碱性,而直接用c(H+)或c(OH-)的大小表示;
测定溶液pH通常可用pH试纸,pH试纸是用多种指示剂混合液浸制而成,若精确测定溶液pH,则应用pH计,
故答案为:酸碱性;碱;酸;大于;c(H+)或c(OH-)的大小;多种指示剂;pH计.
点评 本题考查溶液酸碱性表示方法,知道溶液pH大小与氢离子浓度关系,会正确计算pH,题目难度不大.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:解答题
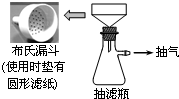 卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化.某实验小组通过如下实验对卷心菜中维生素C的含量进行测定.
卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化.某实验小组通过如下实验对卷心菜中维生素C的含量进行测定.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| B. | 一定温度下,1 L 0.50 mol•L-1 NH4NO3溶液中含氮原子个数为NA | |
| C. | 过氧化氢分解制得1.12 L O2,转移电子数目为 0.2 NA | |
| D. | 235g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$Xe+10${\;}_{0}^{1}$n,净产生的中子(${\;}_{0}^{1}$n)数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一.
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
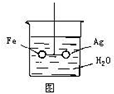 如图,在银圈和铁圈的联接处吊着一个绝缘的细丝,使之平衡,然后小心地从烧杯中央滴入CuSO4溶液.
如图,在银圈和铁圈的联接处吊着一个绝缘的细丝,使之平衡,然后小心地从烧杯中央滴入CuSO4溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③② | C. | ③① | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②⑤⑥ | C. | ③⑤⑥⑦ | D. | ①③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com