
【题目】填空:
(1)________NH3+_______O2![]() ________NO+______H2O,该反应中氧化剂是______,被氧化的元素是________,氧化产物是________。
________NO+______H2O,该反应中氧化剂是______,被氧化的元素是________,氧化产物是________。
(2)若有1 mol O2参加,则反应中转移电子是______mol。
(3)配平该反应方程式并用单线桥标出电子转移的方向和数目____________________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某盐的混合物中含有0.2mol Na+、0.4mol Mg2+、0.4mol Cl-、0.1mol Al3+及一定量的SO42-,则其中所含SO42-的物质的量为
A. 0.1mol B. 0.3mol C. 0.5mol D. 0.45mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子键的强弱主要决定于离子半径和离子电荷数,一般规律是:离子半径小,离子所带电荷值大, 则离子键越强。①K2O ②MgO ③CaO三种物质离子键由强到弱的顺序是 ( )
A.K2O、MgO、CaO
B. MgO、CaO 、K2O
C. MgO、K2O、CaO
D. CaO、K2O 、MgO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.
请回答下列问题:
(1)阳离子交换膜把电解槽隔成了阴极室和阳极室,电解食盐水时,它只允许 (填离子符号)通过。
(2)为了去除粗盐中混有的Ca2+、Mg2+、SO42-.下列选项中所加试剂(均为溶液)及加入顺序均合理的是 (填选项字母)
A.先加足量的BaCl2,再加足量的Na2CO3,最后加入适量稀盐酸
B.先加入足量的NaOH.再加入足量的BaCl2,然后加入足量Na2CO3,最后加入适量稀盐酸
C.先加足量的Na2CO3,再加足量的BaCl2,然后加足量的NaOH,最后加入适量稀盐酸.
D.先加足量的Ba(NO3)2,再加足量NaOH,然后再加足量的Na2CO3,最后加入适量稀盐酸.
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.

图中X、Y分别是 、 (填化学式),分析比较图示中氢氧化钠质量分数 a、b、c的从大到小的顺序为
分别写出燃料电池中正极、负极上发生的电极反应正极: ;负极: ;
这样设计的主要节(电)能之处在于(任写出一条)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下列实验探究金属铝与铜盐溶液反应:下列说法正确的是( )
A. 由实验1 可以得出结论:金属铝的活泼性弱于金属铜
B. 实验2 中生成红色物质的离子方程式:Al+Cu2+═Al3++Cu
C. 溶液中阴离子种类不同是导致实验1、2 出现不同现象的原因
D. 由上述实验可推知:用砂纸打磨后的铝片分别与浓度均为0.2molL﹣1的盐酸和硫酸反应,后者更剧烈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料。
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2![]() 2NH3。该可逆反应达到平衡的标志是________________。
2NH3。该可逆反应达到平衡的标志是________________。
A.3v(H2)正=2v(NH3)逆
B.单位时间生成m mol N2的同时消耗3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
E.a molN≡N键断裂的同时,有6amolN—H键断裂
F.N2、H2、NH3的分子数之比为1∶3∶2
(2)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25min时,以N2表示的平均反应速率= ;该温度下平衡常数K= ;
(3) 利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H=-99kJ·mol-1
CH3OH(g) △H=-99kJ·mol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-58 kJ·mol-1
CH3OH(g)+H2O(g) △H=-58 kJ·mol-1
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H
CO(g)+H2O(g) △H
图1中能正确反映平衡常数K随温度变化关系的曲线是 ;反应③的△H= kJ·mol-1。
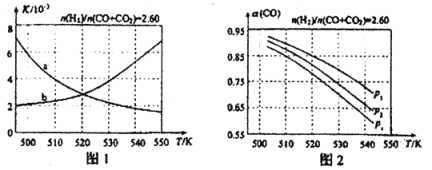
(4)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率α(CO)与温度和压强的关系如图2所示。图中的压强p1、p2、p3由大到小的顺序为 ;α(CO)随温度升高而减小,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完全沉淀等物质的量浓度的NaCl、MgCl2、AlCl3溶液中的Cl—,消耗等物质的量浓度的AgNO3溶液的体积比为3:2:1,则上述溶液的体积比为( )
A. 1:1:1 B. 3:2:1
C. 6:3:2 D. 9:3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属和非金属及其化合物在日常生产生活中有着广泛的运用,请回答下列问题:
(1)硅单质、硅的氧化物、硅酸盐产品在日常生活中广泛的运用:
①硅在周期表中的位置:
②硅酸钠是为数不多的溶于水的硅酸盐,硅酸钠显 性,向硅酸钠溶液中通入足量CO2有白色沉淀产生,写出该反应的离子反应方程式:
(2)铜不能与稀硫酸共热发生反应,但在过氧化氢与稀硫酸的混合溶液中加入铜片,常温下就生成蓝色溶液。写出有关反应的化学方程式: 。硫酸在该反应中表现的性质是
(3)纳米金属铁能高效地降解毒性强、难生物降解的有机卤化物,科技工作者利用Fe2O3和CH4在一定条件下制得纳米级单质铁,同时两种可燃性气体,则该反应的化学反应方程式为:
(4)Fe3O4是磁铁矿的主要成分,Fe3O4可用于制造录音磁带和电讯器材等。高温下,铝粉能与Fe3O4发生铝热反应,该反应的化学方程式为 。34.8g Fe3O4与足量稀硝酸反应,被还原HNO3的物质的量为 mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com