
【题目】下列描述和解释均正确且有对应关系的是( )
选项 | 描述 | 解释 |
A | 84消毒液可以消灭新型冠状病毒 |
|
B | 用灼烧法鉴别纤维素和聚乙烯塑料 | 纤维素有烧焦羽毛的气味 |
C | 《易经》载有“泽中有火”上火下泽” | 燃烧的气体可能为水煤气 |
D | 《四川盐法志》记载;当煮盐近于饱和时,往卤水中点加豆汁,至渣滓皆浮聚于面 | 加豆汁除渣利用了胶粒的吸附作用 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是质子数依次增大的短周期主族元素,它们形成的某种化合物Q的结构式如图所示。X与W形成的化合物M常温下是液体。下列说法正确的是
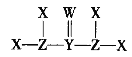
A.X与Z可形成质子数、电子数均相同的ZX3、![]()
B.M热稳定性强且具有弱氧化性
C.Q分子中各原子最外电子层均达到稳定结构
D.X、Y、Z、W四种元素间只能形成共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体A,B分别为0.6mol和0.5mol,在0.4L密闭容器中发生反应:3A+B![]() aC+2D,经5min后,此时气体C为0.2mol;又知在此反应时间内,D的平均反应速率为0.1mol/(L·min),下面的结论正确的是( )
aC+2D,经5min后,此时气体C为0.2mol;又知在此反应时间内,D的平均反应速率为0.1mol/(L·min),下面的结论正确的是( )
A.此时,反应混合物总物质的量为1molB.B的转化率40%
C.A的平均反应速率为0.1mol/(L·min)D.a值为2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,1mol化学键断裂形成气态原子所需要的能量用![]() 表示。结合表中信息判断下列说法不正确的是( )
表示。结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ/mol) | 436 | 157 | 568 | 432 | 298 |
A. 432kJ/mol>E(H-Br)>298kJ/mol B. 表中最稳定的共价键是H-F键
C. H2(g)→2H(g) △H=+436kJ/mol D. H2(g)+F2(g)=2HF(g) △H=-25kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人提出可以利用海水(含NaCl)和石灰石为原料制取漂白粉,该方法流程如下:
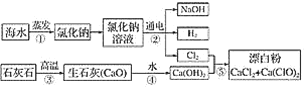
(1)②中的反应物是氯化钠和________,该反应的离子程式为_________。
(2)写出反应④、⑤的化学方程式:_________。
(3)图中反应②③④⑤属于氧化还原反应的是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50mol·L-1 NaOH溶液和0.50mol·L-1硫酸溶液进行反应热的测定。
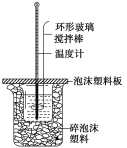
(1)写出该反应的热化学方程式[生成1 molH2O(l)时的反应热为-57.3 kJ·mol-1]:___。
(2)取50 mLNaOH溶液和30 mL 硫酸溶液进行实验,实验数据如表。
①请填写表中的空白:
温度 次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ___ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol·L-1NaOH溶液和0.50mol·L-1硫酸溶液的密度都是1.0g·mL-1,中和后生成溶液的比热容c=4.18J/(g·℃)。则生成1 mol H2O(l)时的反应热ΔH=___(取小数点后一位)。
③上述实验数值结果与-57.3kJ·mol-1有偏差,产生偏差的原因不可能是(填字母)___。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)若1.92 g Cu粉与一定量浓HNO3反应,当Cu完全反应时,收集到标准状况下1.12L气体,则消耗硝酸________mol,生成NO2________mol;
(2)若向Cu中加入硫酸和硝酸的混酸溶液制取CuSO4溶液,则混酸中硫酸与硝酸的最佳物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A. 在250 mL的容量瓶中定容配制250 mL烧碱溶液;
B. 用碱式滴定管移取25.00 mL烧碱溶液于锥形瓶中并滴入2滴甲基橙指示剂;
C. 在天平上准确称取烧碱样品2.0 g,在烧杯中用蒸馏水溶解;
D. 将物质的量浓度为0.100 0 mol·L-1的标准盐酸装入酸式滴定管,调整液面记下开始读数为V1;
E. 在锥形瓶下垫一张白纸,滴定至终点,记下读数V2。
就此实验完成下列填空:
(1)正确的操作步骤的顺序是(用编号字母填写)
________→________→________→D→________。
(2)上述E中锥形瓶下垫一张白纸的作用是_______________________________
(3)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________。直到加入一滴盐酸后,溶液____________________________ (填颜色变化)。
(4)下列操作中可能使所测NaOH溶液的浓度数值偏低的是(____________)
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为________mL。

(6)某学生根据3次实验分别记录有关数据如表:
滴定 次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前 刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该烧碱的纯度____。(结果保留四位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com