
(14分)(1)一个体重50 kg的健康人身体中含铁2 g。铁在人体中不是以游离态的形式存在,而是以Fe2+和Fe3+形式存在。Fe2+易被吸收,给贫血者补充铁时,应给予含Fe2+的盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的Fe3+转化为Fe2+,利于铁的吸收,该过程中维生素C做 剂,Fe3+作 剂,维生素C的还原性______于 Fe2+(填“强”“弱”)
(2)在热的稀硫酸溶液中溶解了11.4 g FeSO4。当加入50 mL 0.5 mol/L KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3也反应完全,并有NxOy氮氧化物气体逸出。
____FeSO4 + KNO3 + H2SO4 = K2SO4 + Fe2(SO4)3 + NxOy + H2O
①配平该化学方程式,用单线桥标出电子转移的方向和数目。
②反应中氧化剂为 ,氮氧化物的化学式为__________
(3)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中, Fe2+离子与酸性高锰酸钾反应的离子方程式为:________________________。羟胺的氧化产物是 。
(1)还原 氧化 强(每空1分)
(2)①6FeSO4 + 2 KNO3 + 4 H2SO4 = 1 K2SO4 + 3 Fe2(SO4)3 + 2 NxOy + 4 H2O(3分)
②KNO3 NO(每空1分)
(3) (每空2分) 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O N2O
【解析】(1)服用维生素C,可使食物中的Fe3+转化为Fe2+,说明维生素C具有还原性,铁离子是氧化剂。由于氧化还原反应中,氧化剂的氧化性强于氧化产物的,还原剂的还原性强于还原产物的,所以维生素C的还原性强于亚铁离子的。
(2)11.4 g FeSO4是0.075mol,反应中失去0.075mol。50 mL 0.5 mol/L KNO3是0.025mol,所以根据电子的得失守恒可知,1mol硝酸钾得到3mol电子。因此氮原子的化合价从+5价降低到+2价,则还原产物是NO。根据电子的得失守恒和原子守恒可配平反应的方程式。
(3)高锰酸钾的还原产物是Mn2+,亚铁离子的还原产物是铁离子,所以反应的方程式是5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;25.00 mL 0.049 mol/L羟胺是0.001225mol,高锰酸钾是0.0245L× 0.020 mol/L=0.00049mol,因此根据电子的得失守恒可知,1mol羟胺失去0.00049×5÷0.001225=2mol,所以氮元素的化合价从-价升高到+1价,因此去氧化产物是N2O。


科目:高中化学 来源: 题型:
 2013年5月4日,中央电视台《焦点访谈》播出了一期节目《管不住的“神农丹”》,曝光了山东潍坊部分农民使用“神农丹”种植生姜的事情.据专家介绍,“神农丹”的主要成分是一种叫涕灭威的剧毒农药,50毫克就可致一个体重50公斤的人死亡,所以不能直接用于蔬菜瓜果.涕灭威分子的结构简式如图所示,下列说法不正确的是( )
2013年5月4日,中央电视台《焦点访谈》播出了一期节目《管不住的“神农丹”》,曝光了山东潍坊部分农民使用“神农丹”种植生姜的事情.据专家介绍,“神农丹”的主要成分是一种叫涕灭威的剧毒农药,50毫克就可致一个体重50公斤的人死亡,所以不能直接用于蔬菜瓜果.涕灭威分子的结构简式如图所示,下列说法不正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
(12分,每空2分)(Ⅰ)一个体重50 kg的健康人含铁元素2 g,这2 g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。
⑴人体中经常进行Fe2+与Fe3+的转化,可表示为Fe2+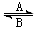 Fe3+。在过程A中,Fe2+作 剂,过程B中,Fe3+作 剂。
Fe3+。在过程A中,Fe2+作 剂,过程B中,Fe3+作 剂。
⑵“服用维生素C可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这个反应中作 剂,具有 性。
(Ⅱ)有人在研究硫酸亚铁(FeSO4)受热分解时,作出了两种假设:
(1)假设它按KClO3受热分解的方式分解,反应的化学方程式为 ;
(2)假设它按CaCO3受热分解的方式分解,反应的化学方程式为 ;
查看答案和解析>>
科目:高中化学 来源:2013届江西省南昌市新建二中高三9月月考化学试卷(带解析) 题型:填空题
(14分)(1)一个体重50 kg的健康人身体中含铁2 g。铁在人体中不是以游离态的形式存在,而是以Fe2+和Fe3+形式存在。Fe2+易被吸收,给贫血者补充铁时,应给予含Fe2+的盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的Fe3+转化为Fe2+,利于铁的吸收,该过程中维生素C做 剂,Fe3+作 剂,维生素C的还原性______于 Fe2+(填“强”“弱”)
(2)在热的稀硫酸溶液中溶解了11.4 g FeSO4。当加入50 mL 0.5 mol/L KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3也反应完全,并有NxOy氮氧化物气体逸出。
____FeSO4 + KNO3 + H2SO4 = K2SO4 + Fe2(SO4)3 + NxOy + H2O
①配平该化学方程式,用单线桥标出电子转移的方向和数目。
②反应中氧化剂为 ,氮氧化物的化学式为__________
(3)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中, Fe2+离子与酸性高锰酸钾反应的离子方程式为:________________________。羟胺的氧化产物是 。
查看答案和解析>>
科目:高中化学 来源:2012届江苏省无锡一中高三9月初检测化学试卷 题型:填空题
(12分)(1)一个体重50 kg的健康人身体中含铁2 g。铁在人体中不是以游离态的形式存在,而是以Fe2+和Fe3+形式存在。Fe2+易被吸收,给贫血者补充铁时,应给予含Fe2+的盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的Fe3+转化为Fe2+,利于铁的吸收。人体中经常进行Fe2+和Fe3+的转化,反应中,Fe2+作 剂,Fe3+作 剂。“服用维生素C,可使食物中的Fe3+转化为Fe2+”,说明维生素C在反应中做 剂,具有 性。
(2)在热的稀硫酸溶液中溶解了11.4 g FeSO4。当加入50 mL 0.5 mol/L KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3也反应完全,并有NxOy氮氧化物气体逸出。
FeSO4 + KNO3 + H2SO4 = K2SO4 + Fe2(SO4)3 + NxOy + H2O
①配平该化学方程式,用单线桥标出电子转移的方向和数目。
②反应中氧化剂为 ,x= ,y=
(3)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中,羟胺的氧化产物是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com