
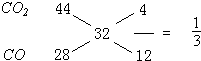


科目:高中化学 来源: 题型:阅读理解
 (2010?江苏二模)以天然气为原料经由合成气(CO、H2)制化学品是目前天然气转化利用的主导技术路线,主要工艺有以下几种:
(2010?江苏二模)以天然气为原料经由合成气(CO、H2)制化学品是目前天然气转化利用的主导技术路线,主要工艺有以下几种:| 1 |
| 2 |
| 气体 | 进口温度/℃ | 进口压强/MPa | 进口流量/g?s-1 | 出口流量/g?s-1 |
| 甲烷 | 464 | 4.26 | 12 | 5.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)连接上述装置的正确顺序是:混合气→( )、( ) →( )、( ) →( )、( ) →( )、( ) →( )、( )。
(2)确认混合气体中含有CO的实验现象是___________,确认混合气体中含有H2的实验现象是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
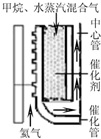
某研究性学习小组对过量炭粉与氧化铁反应中气体产物的成分进行了研究。
【提出假设】 该反应中的气体产物可能是CO或者是CO2和CO的混合物。
【查阅资料】 氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。
【设计方案】 如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉充分反应,测定参加反应的碳元素与氧元素的质量比。
 |
试回答下列问题:
(1) 按上图连接装置,如何检查该装置的气密
性 。
(2) 广口瓶内盛放的试剂为 ,其作用
为 。
(3) 实验开始时,应先打开弹簧夹2一段时间后关闭,同时打开弹簧夹1;再点燃酒精喷灯,理由是
; 。
(4) 称取3.20 g氧化铁、2.00 g炭粉混合均匀,放入质量为48.48 g的硬质玻璃管中;待反应结束,再通一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24 g。经进一步测定得知参加反应的氧元素质量为0.96 g。从而确认该反应的气体产物是CO2和CO的混合物,理由是 。根据数据处理结果判断,反应产生的气体中n(CO2): n(CO)= ,
(5) 有同学根据实验得出的结论,认为应对实验装置进一步完善,你认为应作如何改进?
。
查看答案和解析>>
科目:高中化学 来源:2010年福建省高三上学期第二次月考试卷化学试题 题型:选择题
某混合气体中可能含有H2、CO、CO2、HCl、NH3、和H2O(气)中的两种或多种,当混合气体依次通过:①澄清石灰水(无混浊现象);②氢氧化钡溶液(有混浊现象);③浓硫酸(无明显现象);④灼热的氧化铜(变红);⑤无水硫酸铜(变蓝)。对该混合气体成分的正确判断是( )
A.一定没有CO2,肯定有H2 B.一定有CO、CO2和H2O(气)
C.可能有CO2、NH3、和H2O(气) D.一定有H2、CO2、HCl、
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com