
在2L密闭容器中进行反应C(s)+H2O(g) CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图。下列判断正确的是
CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图。下列判断正确的是
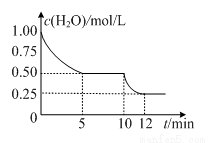
A.0~5min内,v (H2)=0.05mol/(L•min)
B.5min时该反应的K值一定小于12 min时的K值
C.10 min时,改变的外界条件可能是减小压强
D.5min时该反应的v (正)大于11 min 时的v (逆)
 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源:2016-2017学年内蒙古高二上期中化学卷(解析版) 题型:选择题
某物质的球棍模型如图所示,关于该物质的说法不正确的是( )
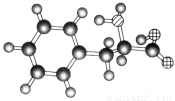
A.该物质的结构简式为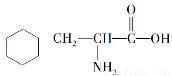
B.该 物质可以发生加成反应
物质可以发生加成反应
C.该物质既可以与强酸反应也可以与强碱反应
D.该物质可以聚合成高分子物质
查看答案和解析>>
科目:高中化学 来源:2017届湖北省襄阳市四校高三上学期期中化学试卷(解析版) 题型:选择题
25°C时,某化学实验小组同学向用大理石和稀盐酸制备CO2后的残留液中滴加碳酸钠溶液,在溶液中插入pH传感器,测得pH变化曲线如图所示。下列说法不正确的是( )
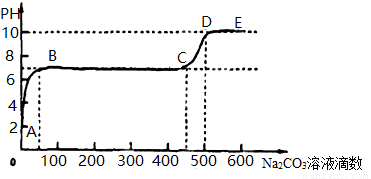
A.开始时溶液pH=2是因为残留液中还有盐酸剩余
B.BC段表示随着碳酸钠溶液的滴入,CaCO3沉淀的质量逐渐增加
C.滴入500滴碳酸钠溶液后溶液中c(OH-)>c(H+)
D.AB发生的反应为:Ca2+ + CO32-== CaCO3↓
查看答案和解析>>
科目:高中化学 来源:2017届广东省汕头市高三上期中化学试卷(解析版) 题型:选择题
高铁酸钾是一种高效绿色水处理剂,其工业制备的反应原理为:2Fe(OH)3 + 3KClO + 4KOH = 2K2FeO4 + 3KCl + 5H2O,下列说法正确的是
A.ClO ?做还原剂 B.Fe(OH)3在反应中被还原[
?做还原剂 B.Fe(OH)3在反应中被还原[
C .高铁酸钾中铁的化合价为+7 D.制备1molK2FeO4时转移3 mol 电子
.高铁酸钾中铁的化合价为+7 D.制备1molK2FeO4时转移3 mol 电子
查看答案和解析>>
科目:高中化学 来源:2017届广东省惠州市高三上学期调研一化学试卷(解析版) 题型:简答题
〔化学-化学与技术〕
工业中以铝土矿(主要成分为Al2O3,另含有Fe2O3和SiO2)为原料冶炼铝过程如图所示:
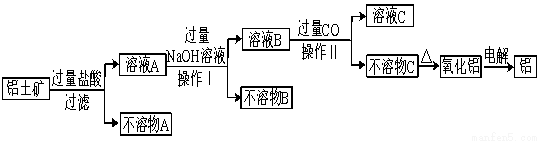
(1) 实验室进行过滤用到的玻璃仪器有烧杯、_____________、_____________。
(2) 操作II中生成不溶物C的离子方程式是 。
(3) 氧化铝的熔点高达2050℃,工业上为降低能耗,在铝的电解冶炼时,采取的措施是 。
(4) 电解冶炼铝时,阳极和阴极以碳素材料制成,电解过程中,阳极材料需定期进行更换,原因是 。
(5) 为了提高综合经济效益,实际工业生产中常将上述反应中的相关物质循环利用。其部分转化关系如下图所示:
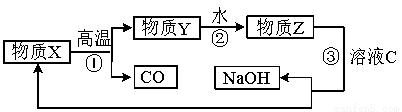
① 上述转化中未涉及四种基本反应类型中的 反应;
② 写出过程③的化学方程式: 。
(6) 研究表明,人体过量吸入铝元素会严重危害身体健康。请你结合实际提出两条杜绝铝元素过量吸入的措施:____________。
查看答案和解析>>
科目:高中化学 来源:2017届广东省惠州市高三上学期调研一化学试卷(解析版) 题型:选择题
化学与生活、社会密切相关,下列有关说法中正确的是
A.“低碳生活”是指生活中尽量使用含碳量较低的物质
B.燃煤中加入CaO后可减少酸雨的发生及温室气体的排放
C.纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一
D.鼓励汽车、家电“以旧换新”,可减少环境污染,发展循环经济,促进节能减排
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上期中考试化学试卷(解析版) 题型:选择题
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体(已知:NH4++OH-=NH3↑+H2O,Al(OH)3+OH-=AlO2-+2H2O),同时产生2.14g红褐色沉淀;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的白色沉淀。由此可知原溶液中
A.至少存在5种离子
B.Cl-一定存在,且c(Cl‑)≥0.4mol/L
C.SO42-、NH4+、Fe3+一定存在,Cl-可能不存在
D.CO32-、Al3+一定不存在,K+可能存在
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上期中化学试卷(解析版) 题型:填空题
将废旧锌锰电池处理得到含锰混合物,既能减少它对环境的污染,又能实现废电池的资源化利用。
Ⅰ. 回收二氯化锰:将废旧锌锰电池处理,得到含锰混合物,向该混合物加入浓盐酸并加热。
(1)写出MnO(OH)与浓盐酸反应的化学方程式:_________。
Ⅱ. 锰回收新方法:向含锰混合物加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止,其主要反应为:2MnOOH + MnO2 + 2H2C2O4 + 3H2SO4 == 3MnSO4 + 4CO2↑ + 6H2O
(2)与使用浓盐酸回收锰相比,新方法的优点是_________(答1点即可)。
(3)欲以MnSO4溶液为原料制备MnCO3,选用的加料方式___________(填字母),原因是___________。
已知:Ksp(MnCO3)=2.3×10﹣11、Ksp[Mn(OH)2]=2.1×10﹣13
a. 将MnSO4溶液与Na2CO3溶液同时加入到反应容器中
b. 将MnSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c. 将Na2CO3溶液缓慢加入到盛有MnSO4溶液的反应容器中
d. 以上三种方式都无法得到MnCO3.
Ⅲ. 现以含锰混合物为原料制备锰锌铁氧体的主要流程如图l所示:
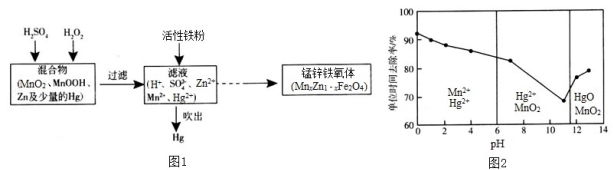
请回答下列问题:
(4)MnxZn1﹣xFe2O4中铁元素化合价为+3,则锰元素的化合价为___________。
(5)活性铁粉除汞时,铁粉的作用是_________(填“氧化剂”或“还原剂”)。
(6)酸浸时,MnO2与H2SO4、H2O2反应的离子方程式为__________________。
(7)除汞是以氮气为载气吹入滤液中,带出汞蒸气经KMnO4溶液进行吸收而实现的。在恒温下不同pH时,KMnO4溶液对Hg的单位时间去除率及主要产物如图2所示:
①写出pH=10时KMnO4溶液吸收汞蒸气的离子方程式________________。
②在强酸性环境中汞的单位时间去除率高,其原因除氢离子浓度增大使KMnO4溶液的氧化性增强外,还可能是__________________。
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三月考二化学试卷(解析版) 题型:实验题
重铬酸钠晶体俗称红矾钠,是重要的化工产品和强氧化剂。工业上用含有Al2O3、Fe2O3等杂质的铬铁矿【主要成份为Fe(CrO2)2】为主要原料生产重铭酸钠晶体(Na2Cr2O7·2H2O)的主要工艺流程如下:
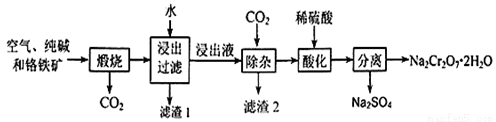
已知:铬铁矿在空气中与纯碱煅烧生成Na2CrO4和一种红棕色固体,放出CO2气体,同时发生反应:A12O3+Na2CO3 2NaAlO2+CO2↑。请回答下列问题:
2NaAlO2+CO2↑。请回答下列问题:
(1)煅烧前通常将铬铁矿粉碎,原因是 。
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成 。
(3)滤渣2的成分为 (填写化学式)
(4)请写出用稀硫酸酸化处理时发生反应的离子方程式 、 。
(5)称取重铬酸钠晶体试样2.500g配成250ml溶液,取出25ml于锥形瓶中,加入10mL 2mol/ LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放置于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断滴定达到终点的现象是 ;
②若实验中共用去Na2S2O3标准溶液40.00ml,则所得产品Na2Cr2O7·2H2O的纯度为 (设整个过程中其它杂质不参加反应)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com