
| A. | 食盐水、糖水、冰水都属于混合物 | |
| B. | 烧碱、火碱、消石灰都属于碱 | |
| C. | KHSO4、HCl、HNO3在水中都能电离出氢离子,都属于酸 | |
| D. | 溶液、胶体、浊液都属于稳定的分散系 |
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:实验题
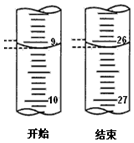 盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.
盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 CO↑+H2O.
CO↑+H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凭气味和颜色 | |
| B. | 通入AgNO3溶液 | |
| C. | 干燥的蓝色石蕊试纸,观察其颜色变化 | |
| D. | 紫色石蕊试液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 | |
| B. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 | |
| C. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| D. | 某溶液中先滴加少量BaCl2溶液,再滴加足量稀盐酸,生成白色沉淀,证明该溶液一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某溶液中含有Ba2+,Mg2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如图(已知溶液2为无色溶液)
某溶液中含有Ba2+,Mg2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如图(已知溶液2为无色溶液)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅④⑤ | B. | 仅③④⑥ | C. | 仅⑥⑦ | D. | 仅①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
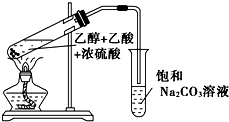 实验室制备乙酸乙酯,是将3mL乙醇加入一支试管中,然后边振荡试管,边慢慢加入2mL浓H2SO4和2mL乙酸,按如图连接好装置,在酒精灯上加热.观察现象.
实验室制备乙酸乙酯,是将3mL乙醇加入一支试管中,然后边振荡试管,边慢慢加入2mL浓H2SO4和2mL乙酸,按如图连接好装置,在酒精灯上加热.观察现象.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com