
| A. | FeCl2 | B. | NaCl | C. | FeCl3 | D. | CuCl2 |
分析 Cl2有强氧化性,当与变价金属反应时将金属氧化成高价态,与盐酸反应考虑金属活动性顺序据此回答判断.
解答 解:A、金属铁和氯气之间反应生成氯化铁,不能用Cl2跟金属直接化合制取,故A错误;
B、钠与氯气反应生成氯化钠,钠与盐酸反应生成氯化钠和氢气,所以氯化钠既能通过金属单质与足量Cl2反应得到,也能通过金属单质与酸反应得到,故B正确;
C、金属铁和盐酸反应生成FeCl2,故C错误;
D、金属铜和氯气之间反应生成氯化铜,能用Cl2跟金属直接化合制取,但与盐酸不反应,故D错误;
故选B.
点评 本题考查氯气的性质和金属的活泼性,比较基础,清楚常见变价金属与氯气反应生成高价态金属氯化物.


科目:高中化学 来源: 题型:选择题
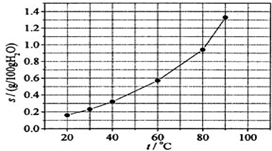
| A. | 温度升高时溴酸银溶解速度加快 | |
| B. | 若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 | |
| C. | 60℃时溴酸银的Ksp约等于6×10-4 | |
| D. | 溴酸银的溶解是放热过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属元素单质的熔点随核电荷数增大而升高 | |
| B. | 同一周期元素的原子,半径越小越容易失去电子 | |
| C. | 第ⅥA族元素的氢化物相对分子质量越大,沸点越高 | |
| D. | 卤族元素的原子序数越大,其单质的沸点一定越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
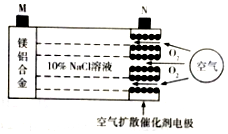 中科院宁波材料所研发金属空气电池获得重大突破.该电池的工作原理如图所示:下列有关说法正确的是( )
中科院宁波材料所研发金属空气电池获得重大突破.该电池的工作原理如图所示:下列有关说法正确的是( )| A. | 电池工作时,负极附近溶液的pH升高 | |
| B. | 电池工作时,电流由M极经外电路流向N极 | |
| C. | 电路中转移2mol电子,理论上约消耗标准状况下空气56L | |
| D. | 电池总反应为4Al+3O2=2Al2O3、2Mg+O2=2MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05mol/L | B. | 0.03mol/L | C. | 0.3mol/L | D. | 0.04mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z的分解速率和Y的生成速率相等 | |
| B. | 单位时间内生成nmolZ,同时生成nmolX | |
| C. | 反应体系的总质量保持不变 | |
| D. | X、Y、Z的浓度不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙溶于盐酸:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 钠投入水中:Na+H2O═Na++2OH-+H2↑ | |
| C. | 铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 氢氧化钡溶液滴入稀硫酸中:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
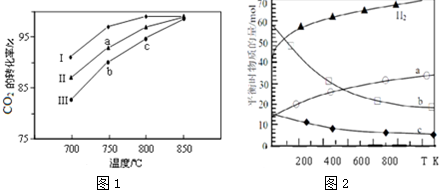
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com