
����Ŀ����ͭ����Ҫ�ɷ�Cu2S,���̿���Ҫ�ɷ�MnO2�����Ƕ���������SiO2��Fe2O3�����ʡ���ҵ���ۺ����������ֿ����Ʊ������̺ͼ�ʽ̼��ͭ����Ҫ�����������£�
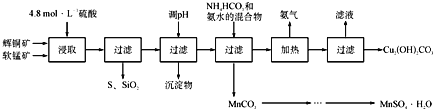
��֪��
��MnO2�ܽ����������е�������Ϊ������
��[Cu(NH3)4]SO4�����ȶ�������ˮ�л�ֽ�����NH3��
��MnSO4��H2O��������ˮ�������ھƾ�;
�ܲ��ֽ�����������������ģ���ʼ������pH����������Ũ��Ϊ1.0 mol��L-1���㣺������Ũ��С��1.0��10-5ʱ����Ϊ�����ӳ�����ȫ��):
Ksp(Fe(OH)3)=1.0��10-38, Ksp(Cu(OH)2)=1.0��10-20�� Ksp(Mn(OH)2)=4.0��10-14
��1�����ʱ���õ��Ľ���Һ����Ҫ����CuSO4��MnSO4�ȡ�д���÷�Ӧ�Ļ�ѧ����ʽ_________________________________��
��2����pH�ķ�ΧΪ____________��
��3���ڸù����п�ѭ��ʹ�õ�������______________�������������� ���ڣ��¶Ȳ��ܹ���Ҳ���ܹ��ߵ�ԭ��Ϊ___��
��4�����������ͼʾ��������̼���̾�һϵ�в������MnSO4��H2O���壬���ⶨ���ȡ���ʵ�鷽������������
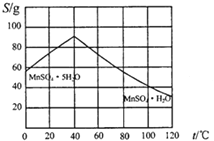
�ٽ�̼���̹�������ϡ��������������Һ;
�ڼ�����Һ�������¶�>40�棬_________�õ��ֲ�Ʒ��
��_______�����¸���ɵõ��ϴ����塣
�����ⶨ��Ʒ��Ĵ��ȣ�ȡ14.00g���������ˮ���100mL��Һ����ȡ25.00mL,��������BaCl2��Һ���õ�����4.66g�������Ʒ�Ĵ���Ϊ___(������λ��Ч����)��ijС����㷢�ֱ�����Ʒ���ȴ���100%(�ⶨ�����в��������ɺ���)�������ԭ����__(��дһ��)��
���𰸡� Cu2S+2MnO2+4H2SO4=2CuSO4+2MnSO4+S��+4H2O 3<pH<4 NH3 �¶ȹ��ͣ�[Cu(NH3)4]SO4�ֽⲻ��ȫ���¶ȹ��ߣ��ᵼ��Cu2(OH)2CO3�ֽ⣬�������������ʹ��ʽ̼��ͭ�������� �����ᾧ�����ȹ��� �þƾ�ϴ�Ӳ�Ʒ2-3�� 96.57% �����л���������(��Է�������С��MnSO4)���ʻ־���ʧȥ�ᾧˮ��
����������1�����������Ϣ��MnO2�ܽ����������е�������Ϊ������Cu2S��MnO2�������Ϻ���������ͭ�����������������ˮ����Ӧ�Ļ�ѧ����ʽCu2S+2MnO2+4H2SO4=2CuSO4+2MnSO4+S��+4H2O����ȷ���� Cu2S+2MnO2+4H2SO4=2CuSO4+2MnSO4+S��+4H2O��
��2������pH��������ʹFe3+ת��ΪFe(OH)3��������ȥ��Ksp(Fe(OH)3)=1.0��10-38,��c(Fe3+)=1.0��10-5 mol��L-1, c��OH-��=10-11 mol��L-1��c��H+��=10-3 mol��L-1��pH=3�����ǵ���ʽ̼��ͭ������Ӧ�ñ���ͭ����ʧ��Ksp(Cu(OH)2)=1.0��10-20����c(Cu2+)=1.0 mol��L-1��c��OH-��=10-10�� c��H+��=10-4 mol��L-1��pH=4�����Ե�pH�ķ�ΧΪ3<pH<4����ȷ�𰸣�3<pH<4��
��3��������������Ͷ�뷴Ӧ��Ͳ�����ﰱ����������ˮ���γɰ�ˮ��Ͷ��ѭ��ʹ�ã��ʿ�ѭ��ʹ�õ�����Ϊ������ ������������ ���ڣ��¶Ȳ��ܹ���Ҳ���ܹ��ߵ�ԭ���¶ȹ��ͣ�[Cu(NH3)4]SO4�ֽⲻ��ȫ���¶ȹ��ߣ��ᵼ��Cu2(OH)2CO3�ֽ⣬�������������ʹ��ʽ̼��ͭ�������٣���ȷ�𰸣��������¶ȹ��ͣ�[Cu(NH3)4]SO4�ֽⲻ��ȫ���¶ȹ��ߣ��ᵼ��Cu2(OH)2CO3�ֽ⣬�������������ʹ��ʽ̼��ͭ�������١�
(4)��������ͼ֪���¶ȵ���40��ʱ����MnSO4��5H2O���壬����40��ʱ����MnSO4��5H2O���壬�����������Һ�Ʊ�MnSO4��5H2O��ʵ����뱣֤��Һ�¶ȸ���40�棻Ȼ��ͨ�������ᾧ�����ȹ������õ��ֲ�Ʒ����ȷ��: �����ᾧ�����ȹ�����
��Ϊ���ٲ�Ʒ����ʧ���þƾ�ϴ�Ӳ�Ʒ2-3�������¸���ɵõ��ϴ���������ȷ�����þƾ�ϴ�Ӳ�Ʒ2-3����
�����ᱵ����Ϊ4.66/233=0.02mol����������ӵ�����Ϊ0.02mol��ԭ�����к��е���������ӵ�����Ϊ0.02��100/25=0.08mol�������̾��������Ϊ0.08��169g�� �����Ʒ�Ĵ���Ϊ0.08��169/14��100%=96.57% ���ñ��Ȼ�����Һ�ⶨ��Ʒ��MnSO4��5H2O��������ʱ��������Ʒ���ȴ���100%��˵����Ʒ�����������������������MnSO4��5H2O�����������������������ֻҪ��������Ʒ���������������������ԭ��������������ԭ������Ʒ�л������������ʻ־���ʧȥ�ᾧˮ����ȷ����96.57% �������л���������(��Է�������С��MnSO4)���ʻ־���ʧȥ�ᾧˮ��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں�CuCl2��MgCl2��HCl����Һ�м�������Zn�ۣ������û���������(����)
A.CuB.H2C.MgD.����ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڢ�FeCl3��Һ����Fe��OH��3����Һ�͢�Fe��OH��3����3�ַ�ɢϵ�У���ɢ�����ӵ�ֱ���ɴ�С��˳���� �� ���������д��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��¡������ܱ������з�����Ӧ: A(s) +2B(g)![]() C(g)+D(g),���������������ٷ����仯ʱ�������÷�Ӧ�Ѵﵽƽ��״̬����
C(g)+D(g),���������������ٷ����仯ʱ�������÷�Ӧ�Ѵﵽƽ��״̬����
�ٻ�������ѹǿ �ڻ��������ܶ� �۸���̬���ʵ����ʵ���Ũ��
������������ʵ��� �ݻ�������ƽ����Է�������
A. �ڢۢ� B. �٢ڢ� C. �ڢۢܢ� D. �٢ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������м���ڹ���������ټ��������ʣ��������������ɵ��ǣ� ��
A. ϡ����B. ����C. �Ȼ�пD. �Ȼ�ͭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(NOCl)���л��ϳ��е���Ҫ�Լ�����ҵ�Ͽ���NO��Cl2��Ӧ�Ƶã��ش���������:
(1)NOCl�����и�ԭ�Ӿ�����8�����ȶ��ṹ����NOCl�ĵ���ʽΪ_______
(2)���������������ڴ����еĺ������������ʱ�����������������漰���·�Ӧ:
2NO2(g)+NaCl(s)![]() NaNO3(s)+NOCl(g)����H1 K1��
NaNO3(s)+NOCl(g)����H1 K1��
4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)����H2 K2;
2NaNO3(s)+2NO(g)+Cl2(g)����H2 K2;
2NO(g)+Cl2(g)![]() 2NOCl(g)����H3 K3;
2NOCl(g)����H3 K3;
��H3=_____(�æ�H1�ͦ�H2��ʾ)��K3=______(��K1��K2��ʾ)
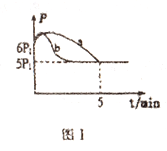
(3)25��ʱ����2L����ѹ�Ƶĺ����ܱ�������ͨ��0.08molNO��0.04molCl2������Ӧ:2NO(g)+Cl2(g)=2NOCl(g)��H
�ٲ����ѹǿ(p)��ʱ��(t)�ı仯��ͼI����a��ʾ(��Ӧ�ﵽƽ��ʱ���¶�����ʼ�¶���ͬ)����H___0(�>����<��);������������ͬ�����ı�ijһ����ʱ�������ѹǿ(p)��ʱ��(t)�ı仯��ͼI����b��ʾ����ı��������______��
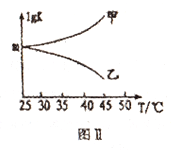
��ͼ���Ǽס���ͬѧ���������Ӧƽ�ⳣ���Ķ���ֵ(lgK)���¶ȵı仯��ϵ��������ȷ��������______ (��ס����ҡ�);mֵΪ_______
(4)NO���ü�ӵ绯ѧ����ȥ����ԭ����ͼ3��ʾ
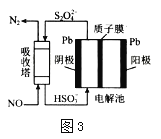
�������ĵ缫��ӦʽΪ_________
���������ڷ�����Ӧ�����ӷ���ʽΪ___________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڼ��������ܷų���������Һ�У��ֱ�������и������ӣ�һ���ܴ����������
A. NH![]() ��SO
��SO![]() ��CO
��CO![]() ��K�� B. Na����Ba2����Ca2����HCO
��K�� B. Na����Ba2����Ca2����HCO![]()
C. Mg2����SO![]() ��K����Cl�� D. K����Cl����Na����SO
��K����Cl�� D. K����Cl����Na����SO![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij��Br-��ˮ����ȡBr2�Ĺ��̰��������ˡ���������ȡ����ѡ�������ȡ����������Ȳ��衣
��֪����2NaOH+Cl2==NaCl+NaClO+H2O
��Br2�����������Ȼ�̼����ʮ����
���� | Br2 | CCl4 | ��ʮ���� |
�ܶ�/g��cm-3 | 3.119 | 1.595 | 0.753 |
�е㣯�� | 58.76 | 76.8 | 215��217 |
��ˮ���ܽ��� | �� | ���� | ���� |

����˵������ȷ����
A. ��װ����Br-�����ķ�ӦΪ��2Br-+Cl2===Br2+2Cl-
B. ��װ����NaOH��Һÿ����1��Cl2��ת��1��e-
C. ����װ�ý�����ȡ���ܽ�Br2���л������²�
D. �ñ�װ�ý����������ռ�������Br2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ�����ӵ�������ֵ������˵������ȷ����( )
A. ��״���£�2.24L ���Ȼ�̼���еķ�����ĿΪ 0.1NA
B. 25��ʱ��0.1 mol��L-1Na2S��Һ�к���Na+����ĿΪ0.2NA
C. 64g��SO2��������O2��ַ�Ӧ��ɵõ�NA��SO3����
D. 2.3gNa��O2��ȫ��Ӧ����3.6g����ʱʧȥ�ĵ�����Ϊ0.1NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com