
����Ŀ�����������(NH4)aFeb(SO4)c��dH2O�ֳ�Ī���Σ���dz��ɫ���壬������������Ҫ��FeS2��SiO2�ȣ��Ʊ�Ī���ε��������£�
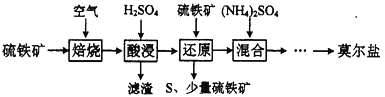
��֪������ԭ��ʱ��FeS2��H2SO4����Ӧ��Fe3+ͨ����Ӧ��ԭ����Ӧ�����£�
FeS2 +14Fe3++8H2O =15Fe2++2SO42-+16H+
��1��д������ԭ��ʱFe3+��FeS2������ԭ��Ӧ������ӷ���ʽ��__________________________��ʵ���Ҽ��顰��ԭ������ȫ�ķ����ǣ�__________________________��
��2����ȡ11.76g����Ī���Σ�����ˮ���250mL��Һ��ȡ25.00mL����Һ����������BaCl2��Һ���õ���ɫ����1.398g����ȡ25.00mL����Һ��0.0200mol/LKMnO4������Һ�ζ�����MnO4-ǡ����ȫ����ԭΪMn2+ʱ��������Һ�����Ϊ30.00mL����ȷ��Ī���εĻ�ѧʽ����д��������̣�_________��
���𰸡� FeS2+2Fe3+=3Fe2++2S�� ȡ������������Һ�������еμ�����KSCN��Һ�������Һ�����ԭ��δ��ȫ����֮������ȫ�� ԭ��Ʒ�е�n(SO42-)��10��1.398g��233g/mol��0.06mol
n(MnO4-)��0.0200mol/L��0.03L��0.0006 mol
�ɵ�ʧ�����غ��֪��n(Fe2+)��5 n(MnO4-)=0.003mol ԭ��Ʒ��n(Fe2+)=0.03 mol
�ɵ���غ��֪��ԭ��Ʒ��n(NH4+)=0. 06mol
�������غ㣺n(H2O)=0.18 mol
�ʻ�ѧʽΪ��(NH4)2Fe(SO4)26H2O��(NH4)2SO4FeSO46H2O
��������������(��Ҫ��FeS2��SiO2��)�ڿ����б��գ��ö����������������������������ȹ��壬�������ܽ⣬���˳�ȥ�������裬����������Һ����������Һ���ټ���������FeS2�������ӻ�ԭΪFe2+��ͬʱ����S���������ˣ���������S����������Һ����Ҫ�������������Ļ����Һ��������Һ�м�������泥���������Ũ�����½ᾧ�����ˣ�ϴ�ӣ�����ɵ�Ī���Ρ�
(1)��������ķ�����֪������ԭ��ʱ���������������������pH����ʱ��Ԫ�ؽ��������²��ʽ��ͣ�����ԭ��ʱFeS2�������ӻ�ԭΪFe2+��ͬʱ����S���������Է�Ӧ������ӷ���ʽΪFeS2+2Fe3+=3Fe2++2S����ʵ���Ҽ�������ԭ������ȫ�ķ�����ȡ������������Һ�������еμ�����KSCN��Һ�������Һ���������ԭ��δ��ȫ����֮������ȫ���ʴ�Ϊ��FeS2+2Fe3+=3Fe2++2S���� ȡ������������Һ�������еμ�����KSCN��Һ�������Һ���������ԭ��δ��ȫ����֮������ȫ��
(2)��ȡ11.76g����Ī���Σ�����ˮ���250mL��Һ��ȡ25.00mL����Һ������������BaCl2��Һ���õ���ɫ�������ᱵ������Ϊ1.398g�������ʵ���Ϊ![]() =0.006mol������n(SO42-)=0.006mol����ȡ25.00mL����Һ��0.0200mol/L KMnO4������Һ�ζ�����MnO4-ǡ����ȫ����ԭΪMn2+ʱ��������Һ�����Ϊ30.00mL���������⣬
=0.006mol������n(SO42-)=0.006mol����ȡ25.00mL����Һ��0.0200mol/L KMnO4������Һ�ζ�����MnO4-ǡ����ȫ����ԭΪMn2+ʱ��������Һ�����Ϊ30.00mL���������⣬
5Fe2+ + MnO42-+8H+=5Fe3++Mn2++4H2O
5 1
n(Fe2+) 0.02000molL-1��0.03L��
����n(Fe2+)=0.003mol�����ݵ���غ㣺n(NH4+)+2n(Fe2+)=2n(SO42-)��n(NH4+)=0.006mol��250mL��Һ��n(SO42-)=0.06mol��n(Fe2+)=0.03mol��n(NH4+)=0.06mol��n(H2O)= ![]() =0.18 mol������n(SO42-)��n(Fe2+)��n(NH4+)��n(H2O)=0 06 mol��0 03 mol��0 06mol��0 18 mol=2��1��2��6������Ī���εĻ�ѧʽΪ(NH4)2Fe(SO4)26H2O[��(NH4)2SO4FeSO46H2O]���ʴ�Ϊ��(NH4)2Fe(SO4)26H2O[��(NH4)2SO4FeSO46H2O]��
=0.18 mol������n(SO42-)��n(Fe2+)��n(NH4+)��n(H2O)=0 06 mol��0 03 mol��0 06mol��0 18 mol=2��1��2��6������Ī���εĻ�ѧʽΪ(NH4)2Fe(SO4)26H2O[��(NH4)2SO4FeSO46H2O]���ʴ�Ϊ��(NH4)2Fe(SO4)26H2O[��(NH4)2SO4FeSO46H2O]��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��Ϊ������Ԫ�أ����������ڱ������λ����ͼ��ʾ����Yԭ�ӵ������������ڲ��������3��������˵����ȷ����
![]()
A. X����̬�⻯���Y���ȶ�
B. W������������Ӧˮ��������Ա�Z��ǿ
C. Z�ķǽ����Ա�Y��ǿ
D. X��Y�γɵĻ����ﶼ������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʷ��������й����У�������ǣ�������
A.����
B.����
C.����
D.����Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С���ͬѧ����ʵ������п��Ũ���ᷴӦ��ʵ���У���ͬѧ��Ϊ�����������Ƕ���������ͬѧ��Ϊ���������������⣬�����ܲ���������Ϊ����֤��λͬѧ���ж���ȷ����ͬѧ�������ͼ��ʾʵ��װ��(п��Ũ���Ṳ��ʱ����������ΪX�����巢��װ����ȥ)���Իش�
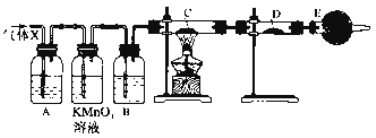
��1��������Ӧ�����ɶ�������Ļ�ѧ����ʽΪ__________________��
��2����ͬѧ��Ϊ�����ܲ���������������__________________��
��3����ͬѧ�ڰ�װ��װ�ú������Ƚ��е�һ�������ǣ�_________________��
��4��A�м�����Լ�������________��������__________________��
B�м�����Լ�������________��������__________________��
E�м�����Լ�������________��������____________________��
��5������֤������X�к���������ʵ�������ǣ�C�У�________��D�У�________�����ȥ��װ��B�����ܷ����D�е������ж�����X����������________(������������������)��ԭ����________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��Ȼ�ѧ����ʽ����������ȷ����
A. ������ȼ����Ϊ-285.5 kJ/mol����ˮ�����Ȼ�ѧ����ʽΪ��2H2O(l)=2H2(g)+O2(g) ��H=+285.5 kJ/mol
B. lmol������ȫȼ������CO2��H2O(l)ʱ�ų�890kJ�����������Ȼ�ѧ����ʽΪ�� ![]() CH4(g)+O2(g)=
CH4(g)+O2(g)= ![]() CO2(g) H2O(l) ��H= -445 kJ/mol
CO2(g) H2O(l) ��H= -445 kJ/mol
C. ��֪C(ʯī��s)![]() C(���ʯ��s) ��H=+1.9kJ/mol������ʯ��ʯī�ȶ�
C(���ʯ��s) ��H=+1.9kJ/mol������ʯ��ʯī�ȶ�
D. 500�桢30MPa�£���0.5molN2��1.5molH2�����ܱյ������г�ַ�Ӧ����NH3(g)������19.3kJ���Ȼ�ѧ����ʽΪ�� N2(g)+3H2(g)![]() 2NH3(g) ��H=-38.6kJ/mol
2NH3(g) ��H=-38.6kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
A. C��H�� 0
B. C��H�� 0��N
C. C��H��0��N��S
D. C��H��0��N�� P
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱ������H2A��HA-��A2-����ˮ��Һ��ϵ�У�H2A��HA-��A2- �����и�����ռ�����ʵ�����������������ҺpH�仯�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
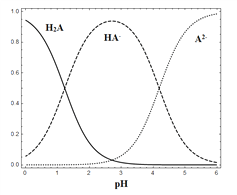
A. �ں�H2A��HA-��A2- ����Һ�У���������NaOH���壬����HA-��һ������
B. �������ʵ�����NaHA��Na2A���������ˮ�����õ���Һ������HA-��=����A2-��
C. NaHA��Һ�У�HA-��ˮ������С��HA-�ĵ�������
D. �ں�H2A��HA-��A2-����Һ�У���c(H2A)+2c(A2-)+c(OH-)=c(H+)��������H2A��������HA-��һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͬѧ��ʳϰ�߿�ѧ���ǣ�������
A.����⣬�ٳ��߲�ˮ��
B.�����������ࡢ��֬�ȣ�ע����ʳƽ��
C.Ϊ��ֹ���֣�����ʱ������
D.�����ô���ˮ�������ÿ�Ȫˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���в���ȷ���ǣ�������
A. H��O���γɼȺ����Թ��ۼ��ֺ��Ǽ��Թ��ۼ��Ļ�����
B. 28g�� C2H4�� C3H6��ɵĻ�����У�Hԭ�ӵ���ĿΪ4NA
C. ��D218O�У�������֮����������֮�͵�����
D. 1mol ��CH3�к��еĵ�����Ϊ9NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com