
已知可逆反应:A(g)+B(g)  C(g)+D(g) ΔH<0。请回答下列问题:
C(g)+D(g) ΔH<0。请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(A)=1 mol/L,c(B)=2.4 mol/L,达到平衡时,A的转化率为60%,此时B的转化率为 。
(2)若反应温度降低,则B的转化率将 (填“增大”、“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(A)=4 mol·L-1,c(B)=a mol·L-1,达到平衡后c(C)=2 mol·L-1,则a= 。
(4)若反应温度不变,反应物的起始浓度分别为c(A)=c(B)=b mol/L,达到平衡后c(D)= 。(保留两位有效数字)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014年高考化学一轮复习课后规范训练9-1练习卷(解析版) 题型:填空题
第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态。
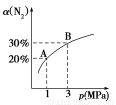
(1)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理示意如图,其总反应式为:H2+2NiOOH 2Ni(OH)2
2Ni(OH)2

根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH (填“增大”、“减小”或“不变”),该电极的电极反应式为 。
(2)Cu2O是一种半导体材料,可通过如图的电解装置制取,电解总反应为:2Cu+H2O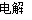 Cu2O+H2↑
Cu2O+H2↑

阴极的电极反应式是 。
用镍氢电池作为电源进行电解,当蓄电池中有1 mol H2被消耗时,Cu2O的理论产量为 g。
(3)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的 腐蚀。为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与像铅酸蓄电池这样的直流电源的 (填“正”或“负”)极相连。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-3练习卷(解析版) 题型:选择题
下列反应不属于水解反应或水解方程式不正确的是( )
①HCl+H2O H3O++Cl-
H3O++Cl-
②AlCl3+3H2O=Al(OH)3+3HCl
③Na2CO3+2H2O H2CO3+2NaOH
H2CO3+2NaOH
④碳酸氢钠溶液:HCO3-+H2O CO32-+H3O+
CO32-+H3O+
⑤NH4Cl溶于D2O中:NH4++D2O NH3·D2O+H+
NH3·D2O+H+
A.①②③④ B.①②③
C.①②⑤ D.全部
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-1练习卷(解析版) 题型:填空题
有pH=4的盐酸、硫酸、醋酸三瓶溶液:(以下用>、<、=表示)
(1)设三种溶液的物质的量浓度依次为c1、c2、c3,则其关系是 。
(2)取相同体积的三种酸分别加入蒸馏水稀释到pH=6,需水的体积依次为V1、V2、V3,则其关系是 。
(3)完全中和体积和物质的量浓度均相同的Ba(OH)2溶液时,需三种酸的物质的量依次为n1、n2、n3,则其关系是 。
(4)取同体积的酸的溶液分别加入足量的锌粉,反应开始放出H2的速率依次为v1、v2、v3,则其关系是 ;反应过程中放出H2的速率依次为va、vb、vc,则其关系是 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-1练习卷(解析版) 题型:选择题
H2O2是一种二元弱酸,对于0.1 mol·L-1的过氧化氢溶液,下列叙述不正确的是( )
A.H2O2的电离方程式可写作H2O2 H++HO2-,HO2-
H++HO2-,HO2- H++O42-
H++O42-
B.加水稀释过程中,K1(H2O2)增大,α(H2O2)增大,c(H+)增大
C.加入少量浓盐酸,过氧化氢的电离平衡逆向移动,水的电离平衡逆向移动
D.加入少量氯化铁溶液,溶液中产生大量气泡
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练7-3练习卷(解析版) 题型:选择题
关于可逆反应mA(g)+nB(g)  pC(g)+qD(g)及其图象的说法正确的是( )
pC(g)+qD(g)及其图象的说法正确的是( )
A.若图象为Ⅰ,则m+n>p+q
B.若图象为Ⅱ,则m+n=p+q,t2时刻改变的条件一定是使用催化剂
C.若图象为Ⅲ,则该可逆反应的ΔH<0
D.若图象为Ⅳ,且压强p1>压强p2,则该可逆反应的ΔH>0
查看答案和解析>>
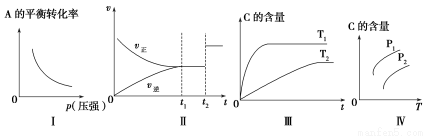
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练7-3练习卷(解析版) 题型:选择题
某温度下,对于反应N2(g)+3H2(g)  2NH3(g) ΔH=-92.4kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是( )
2NH3(g) ΔH=-92.4kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是( )
A.将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
B.平衡状态由A变到B时,平衡常数K(A)<K(B)
C.上述反应在达到平衡后,增大压强,H2的转化率增大
D.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练7-1练习卷(解析版) 题型:填空题
硫?碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2=H2SO4+2HI
Ⅱ.2HI H2↑+I2
H2↑+I2
Ⅲ.2H2SO4=2SO2+O2↑+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2的物质的量随时IP间的变化如图所示。
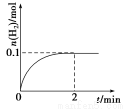
①0~2 min内的平均反应速率v(HI)= 。
②相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.HI的平衡浓度
b.达到平衡的时间
c.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,若加入少量下列固体试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练5-2练习卷(解析版) 题型:填空题
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热
条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液洗后得到无色溶液F,溶液F在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。请回答下列问题:
(1)组成单质A的元素在周期表中的位置是 。
(2)组成单质B的元素的原子结构示意图为 。
(3)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯,该反应的氧化剂为 。
(4)溶液F在空气中长期放置生成H的化学方程式为 。
(5)H的溶液与稀硫酸反应产生的现象为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com