【答案】
分析:(1)①根据碳酸铵加热分解产生氨气、水和二氧化碳;
②根据题干可知将氨气溶于水形成氨水,生成的氨气需通过碱石灰除去二氧化碳、再通入水中即可;
(2)根据盖斯定律来解答;
(3)①化学平衡常数是平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
②设参加反应的氮气的物质的量,再根据三段法求出各自的物质的量,再根据体积分数求出未知数,然后根据v=

计算反应速率;
③根据转化率的概念进行计算;
(4)①加热氮肥样品生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝,该气体为氨气,说明含有铵根离子,另一种气体能使澄清石灰水变浑浊,说明碳酸根离子或碳酸氢根离子,②取少量该氮肥样品溶于水,并加入少量BaCl
2溶液,没有明显变化,说明没有碳酸氢根离子,由此推导出氮肥的主要成分.
解答:解:(1)①碳酸铵加热分解产生氨气、水和二氧化碳,化学方程式为:(NH
4)
2CO
3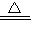
2NH
3↑+CO
2↑+H
2O,故答案为:(NH
4)
2CO
3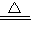
2NH
3↑+CO
2↑+H
2O;
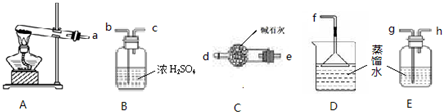
②将氨气溶于水形成氨水,生成的氨气需通过碱石灰除去二氧化碳、再通入水中即可,故答案为:edf;
(2)①N
2(g)+3H
2(g)?2NH
3(g)△H=-92.4kJ?mol
-1 ②2H
2(g)+O
2(g)=2H
2O(l)△H=-572kJ?mol
-1根据盖斯定律,由②×3-①×2得:4NH
3(g)+3O
2(g)=2N
2(g)+6H
2O(l)△H=-1531.2 kJ?mol
-1故答案为:4NH
3(g)+3O
2(g)=2N
2(g)+6H
2O(l)△H=-1531.2 kJ?mol
-1;
(3)①该反应的平衡常数表达式K=

,故答案为:
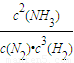
;
②设参加反应的氮气的物质的量xmol,
N
2 +3H
2 
2NH
3开始(mol):1 3 0
变化(mol):x 3x 2x
平衡(mol):1-x 3-3x 2x
5min后达到平衡,平衡时氨的体积分数为
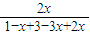
×100%=25%,解:x=0.4,
N
2的反应速率v(N
2)=
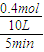
=0.008mol/(L﹒min),故答案为:0.008mol/(L﹒min);
③H
2的转化率为
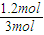
×100%=40%,故答案为:40%;
(4)①加热氮肥样品生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝,该气体为氨气,说明含有铵根离子,另一种气体能使澄清石灰水变浑浊,说明碳酸根离子或碳酸氢根离子;②取少量该氮肥样品溶于水,并加入少量BaCl
2溶液,没有明显变化,说明没有碳酸氢根离子,说明盐中含有铵根离子和碳酸根离子,所以氮肥的主要成分NH
4HCO
3,故选:C.
点评:本题是道综合题,难度不大,涉及知识点较多,注意对应知识的积累.

 计算反应速率;
计算反应速率; 2NH3↑+CO2↑+H2O,故答案为:(NH4)2CO3
2NH3↑+CO2↑+H2O,故答案为:(NH4)2CO3 2NH3↑+CO2↑+H2O;
2NH3↑+CO2↑+H2O; ,故答案为:
,故答案为: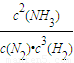 ;
; 2NH3
2NH3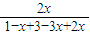 ×100%=25%,解:x=0.4,
×100%=25%,解:x=0.4,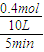 =0.008mol/(L﹒min),故答案为:0.008mol/(L﹒min);
=0.008mol/(L﹒min),故答案为:0.008mol/(L﹒min); 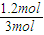 ×100%=40%,故答案为:40%;
×100%=40%,故答案为:40%;


 2NH3,5min后达到平衡,平衡时氨的体积分数为25%.
2NH3,5min后达到平衡,平衡时氨的体积分数为25%.