
 金属及其化合物有广泛的应用.
金属及其化合物有广泛的应用.分析 (1)①先根据MgCl2的物质的量浓度=镁离子浓度来计算浓度,再根据n=cV计算;
②根据稀释前后溶质的物质的量不变,利用C=$\frac{n}{V}$来解答;
(2)发生CuO+2H+=H2O+Cu2+、Fe+Cu2+=Fe2++Cu、Fe+2H+=H2↑+Fe2+,n(Cu0)=$\frac{8.0g}{80g/mol}$=0.1mol,n(H2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,结合反应及c=$\frac{n}{V}$来计算;
(3)该反应中Cl元素化合价由+5价变为0价、-1价变为0价,得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂;
根据原子守恒计算被氧化的浓盐酸物质的量;根据氯气和转移电子关系计算转移电子数.
解答 解:(1)①根据MgCl2的物质的量浓度=镁离子浓度=0.5 mol•L-1,MgCl2的物质的量=0.5 mol•L-1×0.2L=0.1mol,故答案为:0.1mol;
②溶液中的电荷守恒:c(Na+)×1+c(Mg2+)×2+c(Ca2+)×2=c(Cl-)×1,1.0 mol•L-1 +0.5 mol•L-1×2+c(Ca2+)×2=3 mol•L-1×1,c(Ca2+)=0.5 mol•L-1,c(CaCl2)=0.5 mol•L-1,稀释后溶液中Ca2+的物质的量浓度为$\frac{0.5mol/L×0.2L}{1L}$=0.1 mol•L-1,故答案为:0.1 mol•L-1;
(2)n(Cu0)=)=$\frac{8.0g}{80g/mol}$=0.1mol,n(H2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,
发生CuO+2H+=H2O+Cu2+、Fe+Cu2+=Fe2++Cu、Fe+2H+=H2↑+Fe2+,
则Fe+2H+=H2↑+Fe2+,
0.2mol 0.1mol
CuO+2H+=H2O+Cu2+,
0.1mol 0.2mol
所所以n(HCl)=0.2mol+0.2mol=0.4mol,
c(HCl)=$\frac{0.4mol}{2L}$=0.2mol•L-1,
故答案为:CuO+2H+=H2O+Cu2+、Fe+Cu2+=Fe2++Cu、Fe+2H+=H2↑+Fe2+;0.2mol•L-1;
(3)该反应中Cl元素化合价由+5价变为0价、-1价变为0价,得电子化合价降低的反应物是氧化剂,所以氧化剂是KClO3;
因HCl中Cl元素的化合价升高,则HCl为该反应中的还原剂,该反应中只有Cl元素的化合价变化,氯气既是氧化产物也是还原产物,由Cl原子守恒及电子守恒可知,5个Cl原子被氧化,1个Cl被还原,该反应中生成3molCl2转移5mole-,当反应中6molCl2生成时,反应过程转移电子的物质的量是5×2=10mol,有10mol HCl被氧化;
故答案为:KClO3;10mol;10.
点评 本题主要考查了溶液浓度、物质量的计算、铁的化学性质及利用反应的计算以及氧化还原反应的分析计算,侧重分析、计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 L氧气含有的分子数目为nA | |
| B. | 1 mol H2所含有的电子数目为nA | |
| C. | 4.4 g 二氧化碳含有的分子数目为0.1 nA | |
| D. | 1 mol/L CaCl2溶液中含有的氯离子数目为2nA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
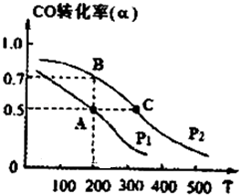 工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2 (g)?CH3OH (g)△H=-116kJ/mol
工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2 (g)?CH3OH (g)△H=-116kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:解答题
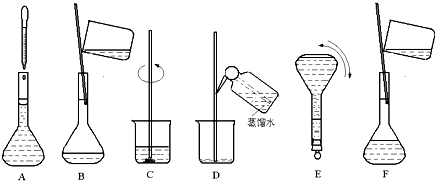
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 将X与Y用导线连接,浸入电解质溶液中,Y极上有气泡产生 |
| 2 | 将片状X、W分别投入等浓度的稀盐酸中都有气体产生,W比X反应剧烈 |
| 3 | 用惰性电极电解等物质的量浓度的Y和Z的硝酸盐混合溶液,在阴极上首先析出Z |
| A. | 上述四种金属中,Z的单质还原性最弱 | |
| B. | w的还原性强于Y的还原性 | |
| C. | Z放人CuSO4溶液中一定有Cu析出 | |
| D. | 用X、Z和稀硫酸可构成原电池,X作负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
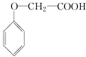 发生化学反应的产物.
发生化学反应的产物. 、
、 等.
等.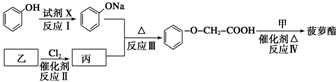
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③④⑦ | C. | ①②④⑦ | D. | ①②③④⑤⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com