
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源:不详 题型:单选题
| A.1:2 | B.2:1 | C.1:1 | D.3:2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.O2和H2O是还原产物 |
| B.该反应能说明O2氧化性大于I2 |
| C.氧化产物与还原产物的物质的量之比是1:1 |
| D.配平后的化学方程式为:2O3+2I-+4H+= I2+2O2+2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氧化性:A2 >B2>C2 >D2 | B.还原性:C->A->B->D- |
| C.2A-+D2 =2D-+A2该反应可以进行 | D.2C-+B2 =2B-+C2该反应也能进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:Fe+H2SO4(稀)
铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:Fe+H2SO4(稀) O
O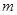 。
。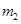 。
。 使之溶解,
使之溶解, 得晶体质量为
得晶体质量为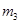 。
。| A.纯碱溶液 | B.烧碱溶液 | C.明矾溶液 | D.稀硫酸 |
 (碱式硫酸铁),该反应的化学方程式为 。
(碱式硫酸铁),该反应的化学方程式为 。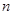 H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。
H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。 晶体的产率为
晶体的产率为  。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
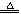 5NaCl+NaClO3+3H2O,以下叙述正确的是( )
5NaCl+NaClO3+3H2O,以下叙述正确的是( )| A.Cl2是氧化剂,NaOH是还原剂 |
| B.被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1 |
| C.Cl2既做氧化剂又做还原剂 |
| D.氧化剂得电子数与还原剂失电子数之比为5∶1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com