
【化学—选修2:化学与技术】
利用天然气合成氨的工艺流程示意如下,完成下列填空:

(1)天然气脱硫采用了Fe(OH)3,Fe(OH)3可以再生循环,可以再生循环.写出上述工艺中由Fe2S3
再生Fe(OH)3的化学方程式是 含硫化合物遇到Fe3+的反应情况与反应条件有关.以NaHS溶液与FeCl3溶液混合为
例:将溶液置于80°C的热水浴中,发现有红褐色沉淀生成,写出该反应的化学方程式:
。解释该反应在温度升高后能发生,
而低温时不易发生的原因
(2) n mol CH4经一次转化后产生CO 0.9n mol,产生H2___mol(用含n的代数式表示)
(3)K2CO3和CO2又反应在加压下进行.加压的理论依据是 (多选扣分)
a.相似相溶原理 B.勒夏特列原理 c艘喊中和原理
(4)整个流程有兰处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,还有一处循环未标明.请指出上述流程图中第三处循环的物质是 ·
(5)工业上制取的硝酸铵的流程图如下.请回答下列问题:

据图2可知工业上氨催化氧生成NO时.应该控制温度在 左右.其中在吸收塔中为了尽可能提高硝酸的产率,减少尾气排放.常常调节空气与NO的比例.写出吸收塔内发生反应的总化学方程式为
科目:高中化学 来源:2015-2016学年江西省高二下期中化学试卷(解析版) 题型:选择题
某有机物在氧气中充分燃烧,生成的CO2和H2O的物质的量之比为1:2,则()
A.分子中C、H、O个数之比为1:2:3
B.分子中C、H个数之比为1:4
C.分子中不可能含有氧原子
D.此有机物的最简式为CH4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二下期中化学试卷(解析版) 题型:选择题
下列有关物质的分离与提纯正确的是
A.取海带样品,灼烧得灰分,再溶解、过滤得到滤液后加CCl4萃取其中的碘
B.做Fe3+和Cu2+的纸层析实验时,用玻璃棒在标记好的原点处轻轻点样3~5次留下斑点
C.抽滤时,当吸滤瓶内液面高度快达到支管口时,应从支管口倒出溶液
D.除去氯化钠中混有的少量硝酸钾,先将混合物溶于水配成热的饱和溶液,然后蒸发水,当有大量晶体析出时,趁热过滤,硝酸钾留在滤液中
查看答案和解析>>
科目:高中化学 来源:2016届河南省原推荐高三四月高考仿真模拟理综化学试卷(解析版) 题型:实验题
为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:已知:相关物质的Ksp(20度) AgCl:1.8×10-10 Ag2SO4:1.4×10-5
(1)甲同学的实验如下:
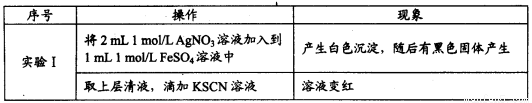
注:经检验黑色固体为Ag。
①白色沉淀的化学式是______________________。
②甲同学得出Ag+氧化了Fe2+的依据是_________________。
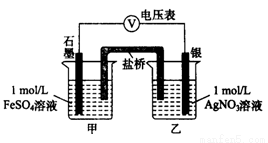
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ。
a.按右图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移。偏移的方向表明:电子由石墨经导线流向银。放置一段时间后,指针偏移减小。
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
①a中甲烧杯里的电极反应式是______________________。
②b中电压表指针逆向偏移后,银为_______________极(填“正”或“负”)。
③由实验得出Ag+和Fe2+反应的离子方程式是___________。
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:

①实验Ⅲ_________(填“能”或“不能”)证明Fe3+氧化了Ag,理由是_______________。
②用化学反应原理解释实验Ⅳ与V的现象有所不同的原因_____________________。
查看答案和解析>>
科目:高中化学 来源:2016届河南省原推荐高三四月高考仿真模拟理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,6.0gNO和2.24LO2混合,所得气体的分子数目为0.2NA
B.常温常压下,1L0.1mol·L-1的硝酸铵溶液中氮原子数目为0.2NA
C.1mol有机物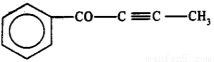 中最多有6NA个原子在一条直线上
中最多有6NA个原子在一条直线上
D.1mol甲基(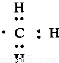 )所含的电子数为7NA
)所含的电子数为7NA
查看答案和解析>>
科目:高中化学 来源:2016届广东省佛山市高三4月二模理综化学试卷(解析版) 题型:选择题
X, Y, Z, M, W为原子序数依次增大的5种短周期元素。X的质子总数与电子层数相同,Y, Z, M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍。Z与其同主族的短周期元素可形成常见的大气污染气体甲。X, Y, Z三种元素形成化合物乙。下列说法错误的是
A.气体甲可与Z的某种氢化物反应生成强酸
B.W元素的晶体单质是一种良好的半导体材料
C.化合物乙中一定只有共价键
D.X分别与Y,Z,M,W形成的常见化合物中,稳定性最好的是XM
查看答案和解析>>
科目:高中化学 来源:2016届浙江省宁波市高考模拟理综化学试卷(解析版) 题型:实验题
由合成气制备乙醇一般有两种方法:
(1)直接合成法①2CO2(g) + 6H2(g)  CH3CH2OH(g) + 3H2O(g) △H1
CH3CH2OH(g) + 3H2O(g) △H1
②2CO(g) +4H2(g)  CH3CH2OH(g) +H2O(g) △H2= -253.6kJ·mol-1
CH3CH2OH(g) +H2O(g) △H2= -253.6kJ·mol-1
(2)间接合成法
合成气反应生成二甲醚(CH3OCH3),二甲醚羰基化合生成乙酸甲酯,乙酸甲酯加氢得到乙醇。其生产流程如下图所示:
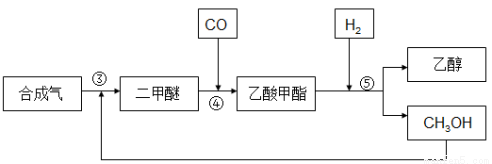
③ 3CO(g) + 3H2(g)  CH3OCH3(g) + CO2 △H3= -260.2kJ·mol-1
CH3OCH3(g) + CO2 △H3= -260.2kJ·mol-1
④ CH3OCH3(g) + CO(g)  CH3COOCH3(g)
CH3COOCH3(g)
回答下列问题:
(1)在5MPa、起始投料量n(H2):n(CO2)=3:1时,测得不同温度时反应①中各物质的平衡组成如图1所示:

①反应①的△H1 0,△S 0。(填“>”、“<”或“=”)
②已知CO(g) + H2O(g)  CO2(g) + H2(g) △H= -41 kJ·mol-1,则△H1= 。
CO2(g) + H2(g) △H= -41 kJ·mol-1,则△H1= 。
③500K时,反应达到平衡后,在t1min时升温到600K,反应在t2min重新达到平衡,请在图2中画出体系中水的体积分数在t1min后的变化曲线。
(2)对反应③处于化学平衡状态时的描述,正确的是 。(填字母)。
A.CO的含量保持不变 B.容器中CH3OCH3浓度与CO2浓度相等
C.3V正(CO)=V正(CH3OCH3) D.体系的温度保持不变
(3)间接合成法中将甲醇(CH3OH)循环使用的目的是 。
(4)在2Mpa、T℃时1L的恒容容器中,充入1.0mol乙酸甲酯和2.0mol氢气,发生反应⑤,经t min后反应达到平衡,测得乙酸甲酯的转化率为75%。则氢气的反应速率v(H2)= ,平衡常数K= 。
查看答案和解析>>
科目:高中化学 来源:2016届天津市高三下学期八校联考化学试卷(解析版) 题型:选择题
下列仪器和装置,用橡胶管经过简单连接,可制备收集多种不同的气体(暂不考虑尾气吸收)。关于这些装置的连接,下列说法正确的是
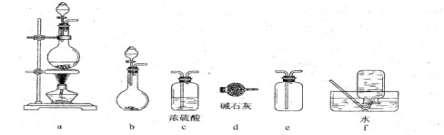
A.制备收集C2H4:连接a→d→f B.制备收集NO2:连接a→c→f
C.制备收集Cl2:连接a→d→e D.制备收集NH3:连接b→d→e
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二下期中化学试卷(解析版) 题型:选择题
利用某有机物之间的转换可以贮存太阳能,如降冰片二烯(NBD)经太阳光照可转化成四环烷(Q),其反应式可表示为: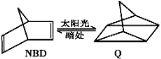 ΔH=+88.62 kJ/mol下列有关说法不正确的是
ΔH=+88.62 kJ/mol下列有关说法不正确的是
A.一定条件下,1molNBD最多可与2molBr2发生加成反应
B.物质Q的能量比NBD的低
C.物质Q的一氯取代物只有3种
D.NBD和Q二者互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com