
【题目】肯定属于同族元素且性质相似的是( )
A. 原子核外电子排布式:A为1s22s2,B为1s2
B. 结构示意图:A为![]() ,B为
,B为![]()
C. A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上也有1个未成对电子
D. A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】能与NaOH溶液,新制Cu(OH)2悬浊液、纯碱溶液、溴水、苯酚钠、甲醇都起反应的是( )
A.CH3COOH B.CH2===CHCOOH
C.盐酸 D.乙酸甲酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项递变规律错误的是:
A. 沸点:NH3<PH3<AsH3 B. 非金属性:N>P>As
C. 还原性:AsH3>PH3>NH3 D. 酸性:HNO3>H3PO4>H3AsO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、D、E、H的焰色反应均呈黄色;G能使带火星的木条复燃;溶 液B中加入AgN03溶液产生浅黄色沉淀;溶液H中加AgN03溶液产生白色沉淀。在一定条件下,各物质可发生如下图所示的变化:
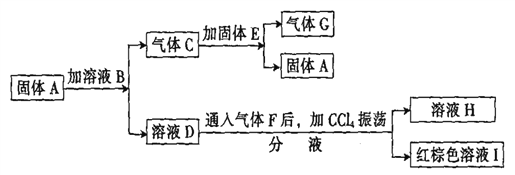
(1)写出A、B的化学式:A __________、 B _________。
(2)写出C和E反应的化学方程式:_________。
(3)写出F通人D溶液反应的离子方程式:_________。
(4)溶液H中加AgN03溶液反应的离子方程式为:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 浓硝酸应保存于无色试剂瓶中
B. 碘是人体必需的微量元素,所以要多吃富含I2的食物
C. 二氧化硫可广泛用于食品的增白
D. 次氯酸钠溶液可用于环境的消毒杀菌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面的排序不正确的是
A. 晶体熔点的高低: >
>
B. 硬度由大到小:金刚石>碳化硅>晶体硅
C. 熔点由高到低:Na>Mg>Al
D. 晶格能由大到小:NaF>NaCl>NaBr>NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:2SO2+O2![]() 2SO3,当其他条件不变时,只改变一个条件,将生成SO3的反应速率的变化填入下表格里(填“增大”、“ 减小”或“不变”)。
2SO3,当其他条件不变时,只改变一个条件,将生成SO3的反应速率的变化填入下表格里(填“增大”、“ 减小”或“不变”)。
编号 | 改变的条件 | 生成的SO3的速率 |
① | 降低温度 | _______ |
② | 升高温度 | _______ |
③ | 增大O2的浓度 | _______ |
④ | 恒容下充入Ne | _______ |
⑤ | 压缩体积 | _______ |
⑥ | 使用催化剂 | _______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、技术密不可分,下列有关说法错误的是
A. 天然气是高效清洁的化石燃料 B. 煤的干馏属于化学变化
C. 油脂可以制取肥皂 D. 我国使用最早的合金是生铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义。
(1)硫酸生产过程中2SO2(g)+O2(g)![]() 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据图回答下列问题:

①2SO2(g)+O2(g)![]() 2SO3(g)的△H__________0(填“>”或“<”),
2SO3(g)的△H__________0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是_________。
a.体系的密度不发生变化 b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化 d.单位时间内反应物转移4 mol 电子,同时消耗2 mol SO3 e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g) ![]() 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。

①升高温度,该反应的平衡常数__________(填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)=________,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为________(填“a”或“b”或“c”或“d”)。
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 ______点,温度T1 ___T2(填“>”或“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com