
A.Mg、Cu、Al、Ag B.Ag、Al、Mg、Cu
C.Cu、Mg、Al、Ag D.Al、Ag、Mg、Cu
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、足量的硫单质与64g铜反应,有1mol电子发生转移 | B、SiO2是酸性氧化物,因此SiO2与酸不反应 | C、Mg比Al活泼,在Mg和Al形成的原电池中,Mg必定做负极 | D、Na2O2与CO2反应生成Na2CO3和O2,SO2和Na2O2反应生成Na2SO3和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将Mg条、Al条平行插入一定浓度的NaOH溶液中,用导线、用电器连接成原电池,此电池工作时,下列叙述中正确的是( )?
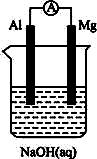
A.Mg比Al活泼,Mg失去电子被氧化成Mg2+?
B.负极反应式为:Al-3e-+4OH-![]() AlO2-+2H2O?
AlO2-+2H2O?
C.该电池的内外电路中,电流均是由电子定向移动形成的?
D.Al是电池阴极,开始工作时溶液中会立即有白色沉淀析出?
查看答案和解析>>
科目:高中化学 来源: 题型:
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3和SiO2组成。某实验小组设计如下流程欲分别制得单质Al、Fe、Mg和Si。

有关氢氧化物沉淀的pH见下表:
金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀的pH |
Fe3+ | 1.9 | 3.2 |
Mg2+ | 9.4 | 11.6 |
请回答下列问题:
(1)滤液A中含有的阳离子有 。
(2)操作②中涉及的化学方程式为 ,
操作④中生成沉淀G的离子方程式为 。
(3)操作⑤中调节pH到5~6时,可以用到的试剂(填序号) 。
a. NaOH溶液 b. 氨水 c. MgO d. Mg(OH)2
(4)从滤液H制取金属Mg的流程如下:
|
流程中由MgCl2冶炼Mg的方法是 。在干燥的HCl气流中加热MgCl2?6H2O制取无水氯化镁的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
为了探究浓度对硫酸氧化性的影响,某学习小组进行了以下探究活动:
[探究一]称取无锈铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
(1)甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,请选择下列试剂,设计简单的实验方案(简述操作过程、现象和结论)
。
供选用试剂:a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性KMnO4溶液
(2)乙同学为了测定气体Y中SO2的含量,设计如下三种方案:
方案I.取672mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。
方案II.向VmL c mol·L-1酸性高猛酸钾溶液中缓慢通入Y气体aL(标准状况),溶液恰好完全褪色。
方案III,取VL(标准状况)气体Y缓慢通入足量的氢氧化钡溶液中,充分反应后,过滤、洗涤、烘干,称得固体质量为mg。
①其中不合理的方案是 ,理由是 。
②选择合理方案的数据计算气体Y中SO2的体积分数
(用含未知数的代数式表示) 。
[探究二]分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体。为此设计了下列探究实验装置(图中夹持装置已省略)。
(3)装置A中试剂的作用是 。
(4)简述确认气体Y中含有CO2的实验现象: 。
(5)有同学根据“F干燥管无水硫酸铜是否变蓝色”确认Y气体中是否有氢气,你认为是否可靠? (填“可靠”或“不可靠”),简述理由: 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com