
 、
、 、
、 、
、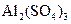 、
、 五种物质中:
五种物质中:科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.1 mol·L-1,60 mL |
| B.0.5 mol·L-1,80 mL |
| C.0.5 mol·L-1,40 mL |
| D.1 mol·L-1,80 mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH=4的该酸溶液和pH=10的氢氧化钠溶液等体积混和后,pH=7。 |
| B.该酸可以分解石灰石放出CO2 |
| C.该酸可以把Al(OH)3沉淀溶解 |
| D.物质的量浓度为O.1mol·L-的该酸溶液pH为l |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.8×10-13%、10-13mol/L |
| B.1.8×10-12%、10-12mol/L |
| C.1.5×10-13%、10-13mol/L |
| D.1.8×10-13%、10-12mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 NH4++NH2-。某温度下其离子积常数为1×10-30(mol·L-1)2。液氨中的pNH4与水中的pH类似,向1L液氨中加入2.3gNa此时上述平衡____________移动(填“向正方向”“向逆方向”或“不”),完全反应后溶液的pNH4=__________。
NH4++NH2-。某温度下其离子积常数为1×10-30(mol·L-1)2。液氨中的pNH4与水中的pH类似,向1L液氨中加入2.3gNa此时上述平衡____________移动(填“向正方向”“向逆方向”或“不”),完全反应后溶液的pNH4=__________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com