某温度下,在一容积固定的容器中,反应aA(g)+bB(g)?hH(g)达到平衡后,A、B、H的物质的量分别为amol、bmol和hmol.已知a+b=h,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是( )
A.气体的平均相对分子质量变大
B.平衡不移动
C.B的体积分数减少
D.混合气体的密度不变
【答案】
分析:A、根据气体的平均相对分子质量=
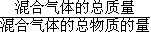
来判断;
B、对于反应前后气体体积不变的反应,增大压强,平衡不移动;
C、根据平衡的移动知识来确定B的体积分数变化情况;
D、根据混合气体的密度=

来判断.
解答:解:A、将三者的物质的量增大一倍,混合气体的质量和气体的物质的量同等程度的增大,所以气体的平均相对分子质量保持不变,故A错误;
B、a+b=h,说明反应前后气体体积不变,将三者的物质的量增大一倍,相当于增大压强,平衡不移动,故B正确;
C、将三者的物质的量增大一倍,相当于增大压强,平衡不移动,B的体积分数不变,故C错误;
D、混合气体的质量是增大的,容积固定,所以混合气体的密度增大,故D错误.
故选B.
点评:本题是一道化学平衡移动知识的题目,考查学生分析和解决问题的能力,难度中等.

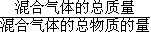 来判断;
来判断; 来判断.
来判断.

