
| A.硫 | B.磷 | C.碳 | D.氯 |
科目:高中化学 来源:不详 题型:填空题
| | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 含氧酸 | 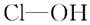 | 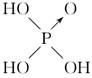 | 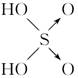 | 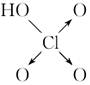 |
| 非羟基 氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 三者酸性由强到弱的顺序为 (用酸的分子式作答);若A是所在周期原子半径最大的元素,则单质A与O2点燃的化学方程式为 。
三者酸性由强到弱的顺序为 (用酸的分子式作答);若A是所在周期原子半径最大的元素,则单质A与O2点燃的化学方程式为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A. C原子采取sp杂化 | B.甲醛分子为三角锥形结构 |
| C. C原子采取sp3杂化 | D.甲醛分子为平面三角形结构 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.水分子的结构式为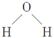 |
| B.氧与氟形成的化合物(OF2)中,氧元素的化合价为-2价 |
| C.Na2O2的电子式为Na+[··············]2-Na+ |
D.在MgO晶体中,O2-的结构示意图可表示为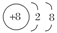 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②③④⑤ | B.①④⑤⑨ | C.②④⑤⑧ | D.④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.键长越长,化学键越牢固 |
| B.成键原子间原子轨道重叠越少,共价键越牢固 |
| C.对双原子分子来讲,键能越大,含有该键的分子越稳定 |
| D.原子间通过共用电子对所形成的化学键叫离子键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.苯分子中含有三个碳碳双键 | B.将乙酸和乙醇混合加热即可制取乙酸乙酯 |
| C.葡萄糖能够发生银镜反应 | D.糖类、油脂、蛋白质均能发生水解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com