
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
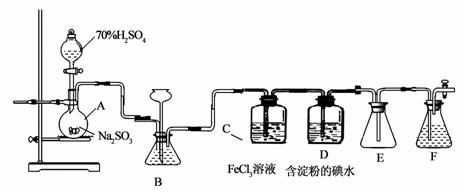
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若 ,则整个装置气密性良好。装置E的作用是 。装置F中为 溶液。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)SO2气体还原Fe3+反应的产物是________________(填离子符号)。
(4)在上述装置中通入过量的SO2为了验证C中SO2与Fe3+发生了氧化还原反应,他们取C中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是____,原因是_______________________________________。
(5)能表明I-的还原性弱于SO2的现象是__________________________,写出有关离子方程式:_______________________________________。
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。2分
(2)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
① 此时溶液中c(SO32–)的浓度是0.2 mol·L-1,则溶液中c(HSO3–)是_______mol•L-1。
② 向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是 。2分
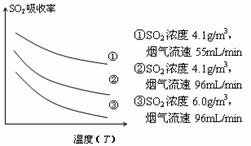
③ 某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示。则: ,有利于提高SO2的吸收效率。2分
(3)工厂仓库存放的Na2SO3药品已部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定其含量,具体步骤如下:
步骤i 称取样品1.000 g。
步骤ii 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤iii 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01000 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
① 写出步骤iii所发生反应的离子方程式_________________________________;
② 在配制0.01000 mol·L-1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量________(填“偏大”、“偏小”或“无影响”)。
③ 某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是 (填字母)。

A B C D E
④ 滴定结果如下表所示:
| 滴定次数 | 待测溶液 的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
则该药品中Na2SO3的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁分别是NaOH、AlCl3、BaCl2、MgCl2四种物质中的一种,若将乙溶液滴入丁溶液中,发现有白色沉淀生成,继续滴加则沉淀消失;乙溶液滴入丙溶液中,无明显现象发生。据此可推断甲物质是
A.BaCl2 B.NaOH C.AlCl3 D.MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质按下图所示转化关系每一步都能一步实现的是( )
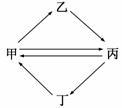
| 甲 | 乙 | 丙 | 丁 | |
| A | FeCl3 | FeCl2 | Fe2O3 | Fe(OH)3 |
| B | Cu | CuO | CuSO4 | CuCl2 |
| C | NO | HNO3 | NO2 | NH3 |
| D | Si | Na2SiO3 | SiO2 | SiF4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学是一门以实验为基础的科学,化学实验是化学学习的重要内容。
(1)根据你掌握的知识,下列描述正确的是 (填序号)
①将0.2mo1·L-1FeC13溶液滴加沸水中,然后继续加热并不断搅拌可制得氢氧化铁胶体;
②将95g蒸馏水倒入盛有5g氯化钠的200ml的烧杯中,搅拌溶解,配制5%的食盐水;
③实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉
④使用容量瓶,滴定管、分液漏斗时,首先应检验仪器是否漏水;
⑤向某溶液中加入Ba(NO3)2溶液有白色沉淀产生,加盐酸沉淀不消失,则原溶液中一定含有SO42-。
(2)实验室中需要480ml0.4mo1·L-1CuSO4溶液,应称取硫酸铜晶体(CuSO4·5H2O)的质量是 g;所用仪器除托盘天平(带砝码)、量筒、烧杯、玻璃棒、药匙外,还缺少的玻璃仪器是 ;在观察液面定容时,若俯视刻度线,会使所配制的溶液的浓度 ;(填“偏高、偏低或无影响”下同) 转移溶液前容量瓶内有少量蒸馏水 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.钠与水反应:
B.硅酸钠溶液与醋酸溶液混合: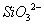 +
+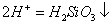
C.0.01mol/LNH4Al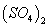 溶液与0.02mol/LBa(OH)2溶液等体积混合:
溶液与0.02mol/LBa(OH)2溶液等体积混合:
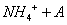 1
1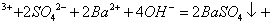 A1
A1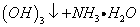
D.向次氯酸钙溶液通入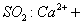
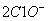 +
+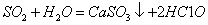
查看答案和解析>>
科目:高中化学 来源: 题型:
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3 主要:Cu2++CO32─+H2O═Cu(OH)2↓+CO2↑
次要:Cu2++CO32─═CuCO3↓
(2)CuSO4+Na2S 主要:Cu2++S2─═CuS↓
次要:Cu2++S2─+2H2O═Cu(OH)2↓+H2S↑
则下列几种物质的溶解度大小的比较中,正确的是( )
|
| A. | CuS<Cu(OH)2<CuCO3 | B. | CuS>Cu(OH)2>CuCO3 | C. | Cu(OH)2>CuCO3>CuS | D. | Cu(OH)2<CuCO3<CuS |
查看答案和解析>>
科目:高中化学 来源: 题型:
将镁带投入盛放在敞口容器的盐酸里,产生H2的速率与时间
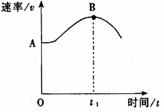 的关系可由右图表示。
的关系可由右图表示。
(1)写出离子反应方程式
(2)在下列因素中①H+的浓度 ②镁带的表面积 ③溶液的温度
④Cl-的浓度 能影响该反应速率的因素有__________(填序号);
(3)解释图中AB段形成的原因 ;
(4)解释图中t1时刻后速率变小的原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com