
| A������ͭ���ȡ����Ƚ������������ɫ��Ӧ��������̻� |
| B�����ʹ��ǽ�̫����ת��Ϊ���ܵij��ò��� |
| C��PM2.5���е�Ǧ���ӡ������������Ԫ�ؾ�Ϊ�������к��Ľ���Ԫ�� |
| D������̼���á����Ե��ܺġ�����Ⱦ�����ŷ�Ϊ�����Ŀɳ�����չ����ģʽ������CO2�ϳɾ�̼������ɽ������ϵ��������ϡ���̼���á���Ҫ�� |


 ����ͬ�����Ծ�ϵ�д�
����ͬ�����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
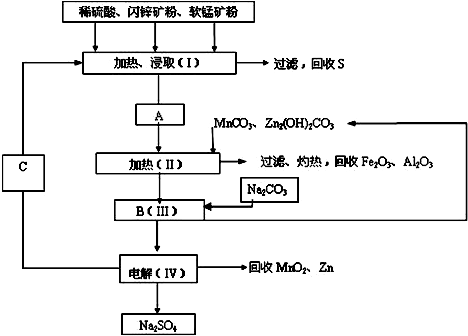
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��һ������Fe3+��Fe2+ |
| B����Һ���ܺ���AlO2- |
| C����Һ���ܺ���NO3- |
| D�����ܺ���Fe3+��һ������Fe2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Ba2+��Na+��Cl-��HSO3- |
| B��NH4+��K+��ClO-��S2- |
| C��Cu2+��Fe2+��NO3-��SO42- |
| D��Ag+��Na+��NH3?H2O��SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����������ޱ��ķ�Ӧ�ǣ�CO2+2OH-=CO32-+H2O |
| B�������������ֹ������ķ�Ӧ�ǣ�2Al+2OH-+2H2O�T2AlO2-+3H2�� |
| C��ȡ�������ڷ�Ӧ�����Һ����μ������������ᣬֻ�ܷ���3����ѧ��Ӧ |
| D�������CO2��ΪNH3��ŨNaOH��Һ��ΪŨ���ᣬ������Ҳ������ȱ��ĵ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��CH4 |
| B��C2H6O |
| C��C6H12O6 |
| D��C2H4Cl2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
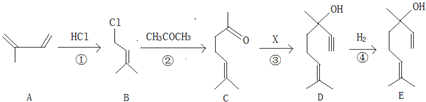
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | CH3OH | CH3OCH3 | H2O |
| Ũ��/��mol?L-1�� | 0.64 | 0.50 | 0.50 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com