
| A. | Li在氧气中燃烧主要生成Li2O2 | |
| B. | 碱金属元素单质都能保存于煤油中 | |
| C. | 卤族元素单质的熔、沸点随原子序数的增大而升高而碱金属元素单质的熔、沸点随原子序数的增大而降低 | |
| D. | 第二周期非金属元素的气态氢化物溶于水后所得水溶液均呈酸性 |
分析 A.Li金属性比Na的弱,燃烧不生成Li2O2;
B.锂单质的密度比煤油小,不能保存在煤油中;
C.卤素单质的熔沸点,随原子序数的增大而升高,而碱金属单质的熔沸点恰好相反;
D.氨气溶于水,溶液显碱性.
解答 解:A.Li金属性比Na的弱,Li与氧气反应生成Li2O,不会生成Li2O2,故A错误;
B.保存在煤油中的碱金属单质的密度必须大于煤油,锂单质的密度比煤油小,需要保存在石蜡油中,故B错误;
C.组成结构相似的分子晶体,相对分子质量越大,熔沸点越高,卤族元素单质随原子序数相对分子质量增大,则熔沸点升高;而碱金属单质的熔沸点随原子序数的增大而降低,故C正确;
D.第二周期非金属元素的气态氢化物溶于水后,水溶液不一定为酸性,如氨气溶于水,溶液显碱性,故D错误;
故选C.
点评 本题考查元素周期律的内容及应用,题目难度不大,明确元素周期律的内容为解答关键,B为易错点,注意常见药品的性质及保存方法,试题培养了学生的灵活应用能力.


 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:实验题
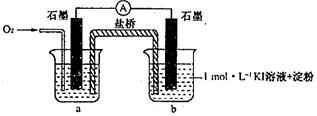
| 序号 | 烧杯中的液体 | 5分钟后现象 |
| ① | 2mL 1mol•L-1KI溶液+5滴淀粉 | 无明显变化 |
| ② | 2mL1mol•L-1KI 溶液+5 滴淀粉+2mL0.2mol•L-1HC1 | 溶液变蓝 |
| ③ | 2mLl mol•L-1KI溶液+5滴淀粉+2mL0.2mol•L-1KC1 | 无明显变化 |
| ④ | 2mL1mol•L-1KI溶液+5滴淀粉+2mL0.2mol•L-1CH3COOH | 溶液变蓝,颜色 较②浅 |
| 序号 | 烧杯中的液体 | 5小时后现象 |
| ⑤ | 2mL混有KOH的pH=8.5的lmol•L-1KI溶液+5滴淀粉 | 溶液略变蓝 |
| ⑥ | 2mL混有KOH的pH=10的lmol•L-1KI溶液+5滴淀粉 | 无明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属Mg和金属Cu的空间利用率 | |
| B. | BF3和CH4中心原子的价层电子对数 | |
| C. | 邻羟基苯甲醛(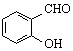 )和对羟基苯甲醛( )和对羟基苯甲醛(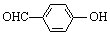 )的沸点 )的沸点 | |
| D. | C-O和Si-O的键能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色植物的光合作用是把热能转化为化学能的过程 | |
| B. | 生物质能是与化学反应无关的一种能源 | |
| C. | 物质燃烧一定是放热反应 | |
| D. | 化学能只能以热能的形式释放 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池是常见的二次电池,性能优良,比能量高,缺点是废弃电池铅污染严重 | |
| B. | 用玻璃棒蘸取KMnO4(H+)溶液,滴在pH试纸上,然后与标准比色卡对照,测定其pH | |
| C. | 石油的分馏、蛋白质的盐析、焰色反应、煤的液化与气化都是物理变化 | |
| D. | 在元素周期表的金属和非金属分界线附近可寻找锗、硅、硒等半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ④⑥ | C. | ③⑥ | D. | ③⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com