
 烧杯中盛有NaHSO4和Na2SO4混合溶液体积为100mL,向烧杯中逐滴加入0.15mol•L-1Ba(OH)2溶液,当沉淀量达到最大值时,溶液的总体积为200mL.溶液中产生沉淀的物质的量n与溶液的pH的变化如图所示.请回答:
烧杯中盛有NaHSO4和Na2SO4混合溶液体积为100mL,向烧杯中逐滴加入0.15mol•L-1Ba(OH)2溶液,当沉淀量达到最大值时,溶液的总体积为200mL.溶液中产生沉淀的物质的量n与溶液的pH的变化如图所示.请回答:分析 当反应2NaHSO4+Ba(OH)2═BaSO4↓+2H2O+Na2SO4,恰好完成溶液呈中性,此时沉淀的量为amol,则NaHSO4的物质的量为2a,继续滴入氢氧化钡当硫酸钠完全反应沉淀达到最大值,沉淀的量为3amol,反应为Na2SO4+Ba(OH)2═BaSO4↓+2NaOH,生成沉淀的物质的量为3a-a=2amol,则根据反应方程式Na2SO4的物质的量为2amol,则原样品中Na2SO4的物质的量为amol,根据硫酸根离子守恒可知:混合溶液中NaHSO4和Na2SO4的物质的量之比为2:1,而沉淀最大量时溶液为单一的氢氧化钠溶液,此时PH=12,所以n(OH-)=n(NaOH)=10-2×0.2=0.002mol,由此分析求解.
解答 解:当反应2NaHSO4+Ba(OH)2═BaSO4↓+2H2O+Na2SO4,恰好完成溶液呈中性,此时沉淀的量为amol,则NaHSO4的物质的量为2a,继续滴入氢氧化钡当硫酸钠完全反应沉淀达到最大值,沉淀的量为3amol,反应为Na2SO4+Ba(OH)2═BaSO4↓+2NaOH,生成沉淀的物质的量为3a-a=2amol,则根据反应方程式Na2SO4的物质的量为2amol,则原样品中Na2SO4的物质的量为amol,根据硫酸根离子守恒可知:混合溶液中NaHSO4和Na2SO4的物质的量之比为2:1,而沉淀最大量时溶液为单一的氢氧化钠溶液,此时PH=12,所以n(OH-)=n(NaOH)=10-2×0.2=0.002mol,
(1)设NaHSO4的物质的量为:2xmol,则Na2SO4的物质的量为xmol,根据钠守恒:2x+2x=0.002,所以x=0.0005mol,原溶液中c(Na2SO4)=0.005mol/L,故答案为:0.005mol/L;
(2)图中a值为硫酸氢钠恰好完全反应的值,所以a为0.0005mol,故答案为:0.0005.
点评 本题考查硫酸盐与氢氧化钡反应的计算,为高频考点,把握图象各阶段的物质的量的关系及各阶段的化学反应为解答的关键,注意反应的先后顺序及利用守恒计算,侧重分析与计算能力的考查,题目难度中等.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
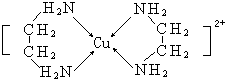
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、
、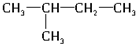 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16g CH4中含有的原子总数为5NA | |
| B. | 78g苯含有碳碳双键的数目为3NA | |
| C. | 1mol/L NaCl溶液中含有的氯离子数目为NA | |
| D. | 标准状态下,11.2L CH3COOH中含有的分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
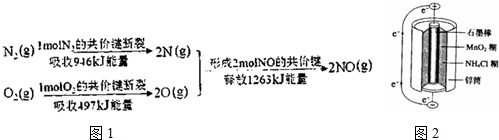
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气和氯气中燃烧,火馅皆呈黄色,但生成固体的颜色不同 | |
| B. | 新制饱和氯水和浓硝酸在光照下会有气体产生,其成分中有氧气 | |
| C. | 亚硫酸露置在空气中酸性减弱 | |
| D. | 灼烧NaOH固体时不能使用瓷坩埚,因为瓷坩埚中的SiO2能与NaOH反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com