
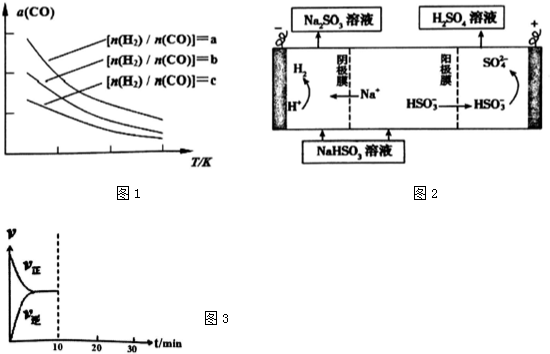
分析 (1)根据图象可知2CO(g)+4H2(g)?CH3OH(g)+3H2O(g),在相同投料比[n(H2)/n(CO)]时,温度升高,CO的平衡转化率降低;
(2)亚硫酸的一级电离方程式为:H2SO3?HSO3-+H+,根据0.02mol•L-1亚硫酸水溶液的pH等于2来计算;
(3)根据盖斯定律,将$\frac{①}{2}$可得目标反应;
(4)根据化合价变化判断阳极反应物质,写出阳极反应式;
(5)SO2(g)+NO2(g)?SO3(g)+NO(g)是气体的物质的量不变的反应,据此分析;由于10min时再通入各1mol的SO2和NO2的,故反应物的浓度增大,则正反应速率v正立即增大,后逐渐减小,最后20min达到平衡.
解答 解:(1)根据图一可以看出,对于反应:2CO(g)+4H2(g)?CH3OH(g)+3H2O(g),在相同投料比[n(H2)/n(CO)]时,温度升高,CO的平衡转化率降低,故升高温度,平衡左移,平衡常数减小,
故答案为:减小;
(2)由于0.02mol•L-1亚硫酸水溶液的pH等于2,即溶液中的氢离子浓度为0.01mol/L,而c(HSO3-)=c(H+),故有:
H2SO3 ?HSO3-+H+
初始浓度:0.02mol/L 0 0
转化浓度:0.01mol/L 0.01mol/L 0.01mol/L
平衡浓度:0.01mol/L 0.01mol/L 0.01mol/L
则有电离平衡常数Ka1=$\frac{0.01mol/L×0.01mol/L}{0.01mol/L}$=0.01,
故答案为:0.01;
(3)已知反应1:2SO2(g)+O2(g)?2SO3(g)△H1;
反应2:2NO(g)+O2(g)?2NO2(g)△H2,根据盖斯定律,将$\frac{①}{2}$可得目标反应:SO2(g)+NO2(g)?SO3(g)+NO(g),则△H3=$\frac{△{H}_{1}-△{H}_{2}}{2}$,而由于△H1<△H2<0,故△H3=$\frac{△{H}_{1}-△{H}_{2}}{2}$<0,故此反应放热,
故答案为:放热;
(4)电解池中阳极和电源正极相连,失去电子,发生氧化反应,电解NaHSO3溶液可制得硫酸,硫的化合价升高,所以阳极是HSO3-溶液失去电子被氧化生成SO42-,则阳极电极反应式是:HSO3-+H2O-2e-=SO42-+3H+,
故答案为:HSO3-+H2O-2e-=SO42-+3H+;
(5)在恒温密闭容器中通入SO2和NO2各1mol发生反应3:SO2(g)+NO2(g)?SO3(g)+NO(g),当反应达到平衡后,维持温度和容积不变,10min时再通入各1mol的SO2和NO2的混合气体,而由于SO2(g)+NO2(g)?SO3(g)+NO(g)是气体的物质的量不变的反应,故平衡不移动,则两次平衡时NO2的转化率α1=α2;由于10min时再通入各1mol的SO2和NO2的,故反应物的浓度立即增大,则正反应速率v正立即增大,后逐渐减小,最后20min达到平衡,故正反应速率v正在10至30min间随时间变化的曲线图为:,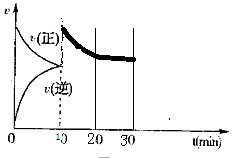 ,
,
故答案为:=;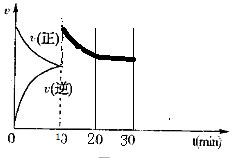 .
.
点评 本题考查化学平衡图象问题,题目难度中等,本题注意反应的特点来分析转化率的变化,本题易错,答题时注意思考.


科目:高中化学 来源: 题型:解答题
 .
.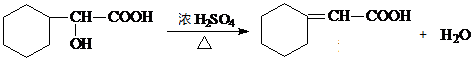 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从1L、1mol/L NaCl溶液中取出10mLNaCl溶液,其浓度仍为1mol/L | |
| B. | 配制0.5L、10mol/L的盐酸,需要氯化氢气体112升(标况) | |
| C. | 0.5L、2mol/L BaCl2溶液中Ba2+ 和 Cl-的总个数约为3×6.02×1023 | |
| D. | 10g、98%的浓硫酸(密度为1.84g/cm3 )与10mL、1.84mol/L的浓硫酸浓度不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片不用特殊方法保护 | |
| B. | 轮船水线下的船体上装一定数量的锌块 | |
| C. | 不纯的铁在潮湿的空气中生锈 | |
| D. | 镀锌铁比较耐用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时,电池正极上发生的反应为:PbO2+2e-+4H++SO42-=PbSO4+2H2O | |
| B. | 充电时,Pb应相连直流电源的正极 | |
| C. | 放电时,负极质量每增重9.6g,溶液中就消耗0.4molH+ | |
| D. | 需要定期补充硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ②④ | C. | ③④ | D. | ①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com