
【题目】某温度下,在体积为2L的密闭容器中充入1mol A和b mol B气体,发生如下反应:A(g)+B(g)2C(g),5min后反应达到平衡时n(A)为0.4mol.在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度的关系如下图所示.下列叙述正确的是( ) 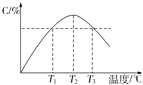
A.0~5 min,C物质的平均反应速率为0.04 molL﹣1min﹣1
B.图中温度T1时的正反应速率等于温度T3时的正反应速率
C.该反应温度T2时的平衡常数大于温度T3时的平衡常数
D.图中T2时,若只增大压强,则正、逆反应速率不改变
【答案】C
【解析】解:曲线上最高点为平衡点,最高点之前未达平衡,反应向正反应进行,最高点之后,各点为平衡点,升高温度C的含量降低,平衡向逆反应,故正反应为放热反应,
A.5min后反应达到平衡时n(A)为0.4mol,则△n(A)=1mol﹣0.4mol=0.6mol,故△n(C)=2△n(A)=1.2mol,故v(C)= ![]() =0.12mol/(Lmin),故A错误;
=0.12mol/(Lmin),故A错误;
B.T1时未到达平衡状态,T3时处于平衡状态,温度越高反应速率越快,T1时的正反应速率小于T3时的正反应速率,故B错误;
C.升高温度平衡向逆反应移动,平衡常数降低,故T2时的平衡常数大于T3时的平衡常数,故C正确;
D.反应前后气体的物质的量不变,增大压强,正、逆反应速率同等程度增大,故D错误;
故选C.
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)═3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.vA=0.5molL﹣1s﹣1
B.vB=0.3 molL﹣1s﹣1
C.vC=0.8 molL﹣1s﹣1
D.vD=1.0 molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为二氧化锰的有关转化关系图,有关说法中不正确的是()

A. 反应①—⑥均属于氧化还原反应
B. 反应②中Cl2既是氧化剂又是还原剂
C. 反应①中氧化剂与还原剂的物质的量之比为1∶4
D. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的价层电子排布图为_______________________。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。电负性:C________(填“>”或“<”,下同)B;第一电离能:N________O,原因是____________________________________。
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO42-的空间构型为_________形,其中硫原子采用_________杂化,写出SO42-的一种等电子体的化学式:____________________________。
(4)Ti的氧化物和CaO相互作用能形成钛酸盐CaTiO3,CaTiO3的晶体结构如图1所示(Ti4+位于立方体的顶点)。该晶体中,Ti4+和周围________个O2-相紧邻。

(5)铁晶胞的结构如图2所示,如果晶胞边长为a,铁原子半径为r,则该晶体中铁原子的空间利用率为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2﹣二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验中可以用图9所示装置制备1,2﹣二溴乙烷.其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴(表面覆盖少量水).请填写下列空白:
(1)烧瓶a要求温度迅速升高到170℃发生反应,写出该反应的化学方程式;该反应类型为 .
(2)写出制备1,2﹣二溴乙烷的化学方程式 .
(3)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时瓶b中的现象 .
(4)容器c中NaOH溶液的作用是;e装置内NaOH溶液的作用是 .
(5)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因(至少2点) . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%.其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( ) A.2 mol C
B.2 mol A、2mol B和1 mol He(不参加反应)
C.1 mol B和1 mol C
D.2 mol
A.3 mol B和3 mol C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钯(Pd)元素的原子序数为46,下列叙述错误的是( )
A. ![]() Pd和
Pd和 ![]() Pd互为同位素 B. Pd核外有46个电子
Pd互为同位素 B. Pd核外有46个电子
C. Pd核内有46个质子 D. ![]() Pd的原子核内有46个中子
Pd的原子核内有46个中子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() (x)、
(x)、![]() (y)、
(y)、![]() (z) 互为同分异构体,下列说法不正确的是( )
(z) 互为同分异构体,下列说法不正确的是( )
A. Z的二氯代物只有三种
B. x、y、z中只有x的所有原了可能处于同一平面
C. x、y可使溴的四氯化碳溶液因发生加成反应而褪色
D. x的同分异构体只有y和z两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铬和氢气在工业上都有重要的用途.已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4). 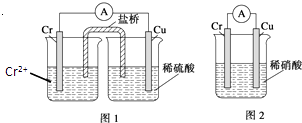
(1)铜铬构成原电池如图1,其中盛稀硫酸烧杯中的现象为: . 盐桥中装的是饱和KCl琼脂溶液,下列关于此电池的说法正确的是: A.盐桥的作用是使整个装置构成通路、保持溶液呈电中性,凡是有盐桥的原电池,盐桥中均可以用饱和KCl琼脂溶液
B.理论上1molCr溶解,盐桥中将有2molCl﹣进入左池,2molK+进入右池
C.此过程中H+得电子,发生氧化反应
D.电子从铬极通过导线到铜极,又通过盐桥到转移到左烧杯中
(2)如构成图2电池发现,铜电极上不再有图1的现象,铬电极上产生大量气泡,遇空气呈红棕色.写出正极电极反应式: .
(3)某同学把已去掉氧化膜的铬片直接投入氯化铜溶液时,观察到了预料之外的现象:①铬片表面上的铜没有紧密吸附在铬片的表面而是呈蓬松的海绵状;②反应一段时间后有大量气泡逸出,且在一段时间内气泡越来越快,经点燃能发出爆鸣声,证明是氢气.请解释这两种现象的原因 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com