
 室温时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是( )
室温时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是( )| A. | pH=4 的溶液中:c(Na+)+c(H+)-c(OH-)=0.1-c(CH3COOH) | |
| B. | W点表示的溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| C. | pH=5的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-) | |
| D. | 向W点所表示的1.0 L 溶液中通入0.05 mol HCl 气体(溶液体积变化可忽略):c(H+)>c(CH3COOH)+c(OH-) |
分析 A.c(CH3COOH)+c(CH3COO-)=0.1mol•L-1,则c(CH3COO-)=0.1mol•L-1-c(CH3COOH),结合电荷守恒分析;
B.醋酸、醋酸钠混合溶液中c(CH3COOH)+c(CH3COO-)=0.1mol•L-1,c(Na+)<0.1mol•L-1;
C.由电荷守恒分析;
D.W点为等量的醋酸和醋酸钠的混合液,1.0 L 溶液中通入0.05 mol HCl 气体得到0.05molNaCl和0.1molHAc.
解答 解:A.c(CH3COOH)+c(CH3COO-)=0.1mol•L-1,则c(CH3COO-)=0.1mol•L-1-c(CH3COOH),溶液中电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(Na+)+c(H+)-c(OH-)=0.1-c(CH3COOH),故A正确;
B.醋酸、醋酸钠混合溶液中c(CH3COOH)+c(CH3COO-)=0.1mol•L-1,c(Na+)<0.1mol•L-1,所以c(Na+)<c(CH3COOH)+c(CH3COO-),故B错误;
C.pH=5的溶液中存在电荷守恒,即c(Na+)+c(H+)=c(CH3COO-)+c(OH-),溶液中c(CH3COOH)≠c(CH3COO-),故C错误;
D.W点为等量的醋酸和醋酸钠的混合液,1.0 L 溶液中通入0.05 mol HCl 气体得到0.05molNaCl和0.1molHAc,由电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(Cl-)可知,c(H+)=c(CH3COOH)+c(OH-),故D错误;
故选A.
点评 本题属于基本概念与理论的考查,落点在水解与电离平衡、物料守恒和电荷守恒、离子浓度大小比较.溶液中存在水解与电离两个过程的离子浓度大小比较似乎是考试热点内容,学习中要反复加强训练,题目难度中等.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
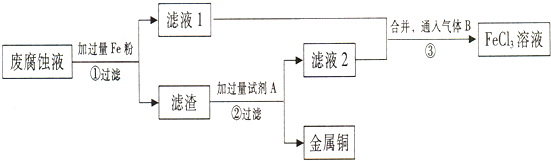
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5Cl | B. | C2H4Cl2 | C. | C2H6 | D. | C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +184.6KJ•mol-1 | B. | 92.3KJ•mol-1 | C. | -369.2KJ•mol-1 | D. | +92.3KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
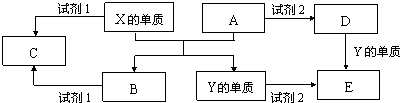
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuO与H2的反应在表面皿上进行 | |
| B. | 蒸发NaC1溶液得到NaCl晶体用蒸发皿 | |
| C. | 加热CuSO4•5H2O获得CuSO4用坩埚 | |
| D. | 盐酸与金属Mg的反应可在试管中进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com