
| A. | Al2O3可用作高温耐火材料 | |
| B. | 利用漂白粉的氧化性漂白织物 | |
| C. | 浓硫酸可刻蚀石英制艺术品 | |
| D. | 在医疗上碳酸氢钠可用于治疗胃酸过多 |
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:选择题
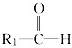 和
和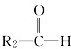 ;
; 被氧化为
被氧化为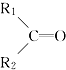 和
和 ,由此推断分子式为C5H10的烯烃的氧化产物有( )
,由此推断分子式为C5H10的烯烃的氧化产物有( )| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C2H2 C2H4 | B. | C2H4 C3H6 | C. | C3H8 C3H6 | D. | C6H6 C2H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液操作时分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 运用蒸馏的方法,可除去水中难挥发性或不挥发的杂质 | |
| C. | 配制0.1000 mol•L-1氯化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此X元素的气态氢化物的化学式为HX,在常温很稳定 | |
| B. | 其单质带有金属光泽,具有强氧化性,可与KI发生置换反应生成I2 | |
| C. | 其单质的分子式为X2,易溶于有机溶剂 | |
| D. | AgX是一种有色的易溶于水的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com