
(17分)(2012?广东)难溶性杂卤石(K2SO4?MgSO4?2CaSO4?2H2O)属于“呆矿”,在水中存在如下平衡
K2SO4?MgSO4?2CaSO4?2H2O(s)?2Ca2++2K++Mg2++4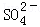 +2H2O
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如图1:
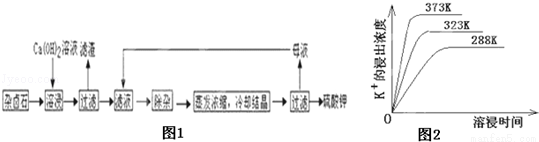
(1)滤渣主要成分有 和 以及未溶杂卤石.
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因: .
(3)“除杂”环节中,先加入 溶液,经搅拌等操作后,过滤,再加入 溶液调滤液PH至中性.
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图2,由图可得,随着温度升高,① ② ;
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+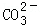 ?CaCO3(s)+
?CaCO3(s)+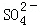
已知298K时,Ksp(CaCO3)=2.80×10﹣9,Ksp(CaSO4)=4.90×10﹣5,求此温度下该反应的平衡常数K (计算结果保留三位有效数字).
(1)CaSO4;Mg(OH)2(2)氢氧根与镁离子结合使平衡向右移动,钾离子变多(3)K2CO3;H2SO4(4)在同一时间K+的浸出浓度大;反应速率加快,平衡时溶浸时间短(5)1.75×104
【解析】(1)依据流程和制取目的,结合“呆矿”,在水中存在的平衡分析,加入饱和Ca(OH)2溶液对平衡的影响分析判断;
(2)依据氢氧化钙和平衡状态下的镁离子结合生成氢氧化镁沉淀,促进平衡右移分析;
(3))“除杂”环节中主要是除去钙离子,但不能引入新的杂质,调节溶液PH呈中性,除去加入的碳酸钾,得到较纯净的硫酸钾,需要加入硫酸调节;
(4)依据图象分析,纵轴意义,曲线的变化,达到平衡需要的时间分析判断;
(5)以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+CO32﹣(aq)?CaCO3(s)+SO42﹣(aq)平衡常数概念写出计算式,依据硫酸钙、碳酸钙溶度积常数的计算表达式,转化关系中钙离子相同计算分析.
【解析】
(1)“呆矿”,在水中存在沉淀溶解平衡:K2SO4?MgSO4?2CaSO4?2H2O(s)?2Ca2++2K++Mg2++4SO42﹣+2H2O,为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,氢氧根离子和镁离子结合生成氢氧化镁沉淀,同时钙离子增多,析出硫酸钙沉淀,所以滤渣中主要成分为CaSO4,Mg(OH)2,故答案为:CaSO4;Mg(OH)2;
(2)Ca(OH)2溶液能溶解杂卤石浸出K+的原因是氢氧化钙是饱和溶液,加入后氢氧根离子和镁离子结合生成氢氧化镁沉淀,促进平衡右移钙离子增多,饱和溶液中析出氢氧化钙,增多K+,故答案为:氢氧根与镁离子结合使平衡向右移动,钾离子变多;
(3)“除杂”环节主要是除去钙离子,依据除杂原则不能引入新的杂质,根据制取的目的是制备硫酸钾,所以加入的试剂易于除去,不引入新的杂质,因此加入过量K2CO3除钙离子,过滤后加入硫酸至中性,除去碳酸钾,故答案为:K2CO3;H2SO4;
(4)分析不同温度下,K+的浸出浓度与溶浸时间的关系,温度越高K+的浸出浓度越大,溶浸时间越短,反应速率越大,达到平衡越快,故图象中分析得到的结论为:温度越高,在同一时间K+的浸出浓度大;反应速率加快,平衡时溶浸时间短,
故答案为:在同一时间K+的浸出浓度大;反应速率加快,平衡时溶浸时间短;
(5)溶浸过程中会发生:CaSO4(s)+CO32﹣(aq)?CaCO3(s)+SO42﹣(aq),CaCO3(s)=Ca2++CO32﹣;CaSO4(s)=Ca2++SO42﹣;依据硫酸钙、碳酸钙溶度积常数的计算表达式,转化关系中钙离子相同计算,反应的平衡常数K=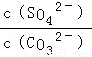 =
=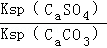 =
=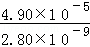 =1.75×104,故答案为:1.75×104.
=1.75×104,故答案为:1.75×104.


科目:高中化学 来源:2013-20147山东省乳山市下学期期中考试高二化学试卷(解析版) 题型:选择题
鉴别乙醇、乙 酸、乙酸乙酯、葡萄糖四种无色溶液,可用的试剂是
酸、乙酸乙酯、葡萄糖四种无色溶液,可用的试剂是
A.石蕊溶液 B.酸性KMnO4 C.溴水 D.新制Cu(OH)2悬浊液
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(海南卷解析版) 题型:选择题
下列实验操作正确的是
A.可用氨水除去试管内壁上的银镜
B.硅酸钠溶液应保存在带玻璃塞的试剂瓶中
C.将三氯化铁溶液蒸干,可制得无水三氯化铁
D.锌与稀硫酸反应时,要加大反应速率可滴加少量硫酸铜
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(新课标解析版) 题型:简答题
【选修2化学与技术】(15分)
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:

(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应
生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物。该过程中两个主
要反应的化学方程式分别是 、
,反射炉内生成炉渣的主要成分是 ;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%--50%。转炉中,将冰铜加
熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化为Cu2O,生成Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是 、 ;
(3)粗铜的电解精炼如右图所示。在粗铜的电解过程中,粗铜板应是图中电极_ _(填图中的字母);在电极d上发生的电极反应式为 ;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 。

查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(新课标解析版) 题型:选择题
分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有(不考虑立体异构)
A.5种 B.6种 C.7种 D.8种
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(广东卷解析版) 题型:选择题
(4分)(2012?广东)下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | SO2有漂白性 | SO2可使溴水褪色 |
B | SiO2有导电性 | SiO2可用于制备光导纤维 |
C | 浓硫酸有强氧化性 | 浓硫酸可用于干燥H2和CO |
D | Fe3+有氧化性 | FeCl3溶液可用于回收废旧电路板中的铜 |
A.A B.B C.C D.D
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(山东卷解析版) 题型:填空题
(12分)(2012?山东)[化学﹣物质结构与性质]金属镍在电池、合金、催化剂等方面应用广泛.
(1)下列关于金属及金属键的说法正确的是 .
a.金属键具有方向性与饱和性
b.金属键是金属阳离子与自由电子间的相互作用
c.金属导电是因为在外加电场作用下产生自由电子
d.金属具有光泽是因为金属阳离子吸收并放出可见光
(2)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是 .
(3)过滤金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n= .CO与N2结构相似,CO分子内σ键与π键个数之比为 .
(4)甲醛(H2C═O)在Ni催化作用下加氢可得甲醇(CH3OH).甲醇分子内C原子的杂化方式为 ,甲醇分子内的O﹣C﹣H键角 (填“大于”“等于”或“小于”)甲醛分子内的O﹣C﹣H键角.
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(大纲全国解析版) 题型:选择题
(2013?潍坊模拟)在常压和500℃条件下,等物质的量的Ag2O、Fe(OH)3、NH4HCO3、NaHCO3完全分解,所得气体体积依次为V1、V2、V3、V4,体积大小顺序正确的是( )
A.V3>V2>V4>V1 B.V3>V4>V2>V1 C.V3>V2>V1>V4 D.V2>V3>V1>V4
查看答案和解析>>
科目:高中化学 来源:2012-2013陕西省富平县高一下学期期末考试化学试卷(解析版) 题型:选择题
下列关于甲烷、乙烯、乙醇、乙酸的说法中,不正确的是 ( )
A.乙烯可以使溴水褪色,发生加成反应
B.甲烷和氯气光照条件下反应,反应类型为取代反应
C.乙醇在铜做催化剂并加热条件下生成乙醛,发生还原反应
D.生活中可以用食醋除去水壶中的水垢,主要是利用了食醋中醋酸的酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com