
【题目】下列物质中属于电解质的是
A. 氨水 B. 二氧化碳气体 C. 铜丝 D. 氢氧化钠固体
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】将1 mol I2(g)和2 mol H2置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) ![]() 2HI(g)ΔH<0,并达到平衡。HI的体积分数w(HI)随时间t变化如图曲线(Ⅰ)所示。
2HI(g)ΔH<0,并达到平衡。HI的体积分数w(HI)随时间t变化如图曲线(Ⅰ)所示。
(1)达到平衡时,I2(g)的物质的量浓度为______________mol·L-1。
(2)若改变反应条件,在甲条件下w(HI)的变化如图曲线(Ⅱ)所示,在乙条件下w(HI)的变化如图曲线(Ⅲ)所示。则甲条件可能是______________,乙条件可能是______________。(填入下列条件的序号)
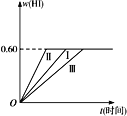
①恒容条件下,升高温度 ②恒容条件下,降低温度 ③恒温条件下,缩小反应容器体积 ④恒温条件下,扩大反应容器体积 ⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g),b mol H2(g)和c molHI(g)(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
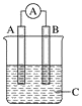
A. A是Zn,B是Cu,C为稀硫酸
B. A是Cu,B是Zn,C为稀硫酸
C. A是Fe,B是Ag,C为稀AgNO3溶液
D. A是Ag,B是Fe,C为稀AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为10 L的密闭容器中,进行如下反应:A(g)+2B(g)![]() C(g)+D(g),最初加入1.0 mol A和2.2 mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),最初加入1.0 mol A和2.2 mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
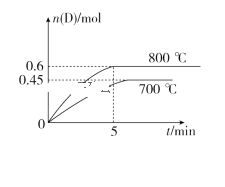
(1)800 ℃时,0~5 min内,以B表示的平均反应速率为________。
(2)能判断该反应达到化学平衡状态的依据是________(填字母)。
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3)利用图中数据计算800 ℃时的平衡常数K=________,该反应为________反应(填“吸热”或“放热”)。
(4)700 ℃时,某时刻测得另一同体积密闭容器中各物质的量如下:n(A)=1.1 mol,n(B)=2.6 mol,n(C)=0.9 mol,n(D)=0.9 mol,则此时该反应________(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号 | T/K | 大理石规格 | HNO3浓度/mol·L-1 | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格(粗、细)对该反应速率的影响; |
② | _____ | _____ | _____ | |
③ | _____ | _____ | _____ | |
④ | _____ | _____ | _____ |
(2)实验装置如图1所示,如何检验该装置的气密性________________________________

(3)实验①中CO2质量随时间变化的关系见下图2:依据反应方程式CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O,计算实验①在70-90 s范围内HNO3的平均反应速率________________________
(4)请在答题卡的框图中,画出实验②、③和④中CO2质量随时间变化关系的预期结果示意图。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关平衡常数的说法中,正确的是 ( )
A. 改变条件,反应物的转化率增大,平衡常数也一定增大
B. 反应2NO2(g)![]() N2O4(g) △H <0,升高温度该反应平衡常数增大
N2O4(g) △H <0,升高温度该反应平衡常数增大
C. 对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等
D. CO2+H2 ![]() CO+H2O的平衡常数表达式为K==
CO+H2O的平衡常数表达式为K==![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com