
芳香化合物A(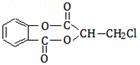 )在一定条件下可以发生如下图所示的转化(其他产物和水已略去)。
)在一定条件下可以发生如下图所示的转化(其他产物和水已略去)。

请回答下列问题:
(1)请写出A的分子式
(2)1molA在氢氧化钠溶液中加热,充分反应消耗氢氧化钠 mol
(3)有机物C可以由乳酸( )经过几步有机反应制得,其中最佳的次序是:
)经过几步有机反应制得,其中最佳的次序是:
a.消去、加成、水解、酸化 b.氧化、加成、水解、酸化
c.取代、水解、氧化、酸化 d.消去、加成、水解、氧化
(4)写出由E制得F的化学方程式: ,反应类型是
(5)有机物B与乙酸酐(CH3COOCOCH3)直接反应制得阿司匹林(即乙酰水杨酸,分子式C9H8O4),满足以下条件的阿司匹林的同分异构体有 种,写出其中核磁共振氢谱是3:2:2:1的结构简式: 、
①苯环上只含有两个侧链 ②有两个酯基 ③能发生银镜反应
科目:高中化学 来源: 题型:
某无色溶液中,已知含有H+、Mg2+、Al3+等阳离子,逐滴加入NaOH溶液发生反应。已知加入NaOH溶液的体积(x轴)和生成的沉淀质量(y轴)之间的关系,可用下图表示,则下列图中描述正确的是( )
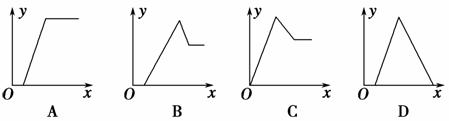
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
A.焰色反应是化学变化
B.水玻璃、漂白粉、胆矾均为混合物
C.酸性氧化物一定不能与酸起反应
D.碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生产、生活密切相关。下列叙述正确的是
A.从海水中可以得到NaCl,电解饱和NaCl溶液可以得到金属Na
B.葡萄糖注射液不能产生丁达尔效应现象,不属于胶体
C. 可用于文物年代的鉴定,
可用于文物年代的鉴定, 与
与 互为同素异形体
互为同素异形体
D.淀粉、油脂和蛋白质都是天然高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
CH4是一种重要的化石燃料,在工农业生产中有着极其重要的应用。
(1)用甲烷可以消除氮氧化物的污染,其反应如下:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)。在130℃和180℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g)。在130℃和180℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
| 实验编号 | 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
(1)130℃时,达到平衡状态时CH4的转化率为 。当温度为180℃、反应到40 min时,该反应 (填“是”或“否”)达到平衡,推断的依据是 。
(2)由表中数据分析可知,该反应的ΔH 0(填“=”、“﹥”或“﹤”),130℃和180℃平衡常数的关系:K(130℃) K(180℃)(填“=”、“﹥”或“﹤”)。
 (3)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
(3)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
①a电极上发生反应的电极反应式是 。
②电镀结束后,装置Ⅰ中溶液的pH (填“增大”、“减小”或“不变”)。
③若完全反应后,装置Ⅱ中Cu极质量减少12.8 g,则装置Ⅰ中理论上消耗甲烷 L(标准状况下)。
(4)用甲烷制取氢气的反应分为两步,其能量变化如下图所示:

写出甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中不正确的是
A.由乙烯制备聚乙烯,发生了加聚反应
B.聚乙烯是有机高分子化合物,加热时,存在一个固定的熔化温度
C.同质量的乙烯和聚乙烯完全燃烧后生成的CO2的质量相等
D.乙烯能使酸性高锰酸钾溶液褪色而聚乙烯不能
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中存在如下反应:A (g)+3B(g)  2C(g);△H<0,某研究小组研究了只改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
2C(g);△H<0,某研究小组研究了只改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:

下列判断一定错误的是
A.图Ⅰ研究的是压强对反应的影响,且乙的压强较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用催化剂的效率较高
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2NO2(g) N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图⑴所示。请回答:
N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图⑴所示。请回答:
(1)a点时,v(正) ▲ v(逆)(填“<”、“>”或“=”),X线、Y线中代表N2O4的是 ▲ ;
(2)反应在第10 min达到平衡,则前10 min内用NO2表示的化学反应速率v(NO2)= ▲ mol·L-1·min-1。该温度下,反应的平衡常数K= ▲ (可用分数表示);
(3)在第25分钟,进行的操作是 ▲ ;
(4)a、b、c、d四点对应的时刻,NO2物质的量浓度由小到大的顺序是 ▲ ,再次平衡时的d点NO2的体积分数比b点时 ▲ (填“大”、“小”或“相等”);
(5)假如在第35分钟从容器中移去0.4mol N2O4,并加入适当催化剂使反应在第40分钟达到平衡,请在图⑴中画出从第35分钟以后两种物质的物质的量浓度c随时间t的变化关系,并标注所画线条对应的物质。

查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作完全正确的是
| 实验 | 操作 | |
| A | 钠与水的反应 | 用镊子从煤油中取出金属钠,切下绿豆大小,放入装满水的烧杯中 |
| B | 配制500mL一定浓度的氯化钾溶液 | 准确称取氯化钾固体,放入到500 mL的容量瓶中,加水溶解、振荡、定容、摇匀 |
| C | 闻氯气法的方法 | 用手轻轻地在瓶口扇动,使极少量氯气飘进鼻孔 |
| D | 分离出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个烧杯,上层液体继续从分液漏斗下端管口放出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com